и твердым углеродом с помощью диаграммы 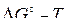
Устойчивость различных оксидов металлов, находящихся в стандартном состоянии – чистое вещество, можно оценить из диаграммы 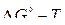 (см. рис. 6) Величина стандартного изменения энергии Гиббса для реакций образования оксидов характеризует химическое сродство к кислороду металлов, углерода и газов СО и
(см. рис. 6) Величина стандартного изменения энергии Гиббса для реакций образования оксидов характеризует химическое сродство к кислороду металлов, углерода и газов СО и 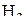 . Чем более отрицательное значение имеет данная величина, тем выше химическое сродство, тем более устойчивым является оксид.
. Чем более отрицательное значение имеет данная величина, тем выше химическое сродство, тем более устойчивым является оксид.
В соответствии с теоретическими положениями о влиянии фазовых превращений на термодинамическую устойчивость оксидов линии 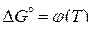 на диаграмме оказываются ломаными в точках фазовых переходов. Точки изломов отмечены для металлов: п – плавление, к – кипение, т – полиморфное превращение; для оксидов металлов: по – плавление, то – полиморфное превращение.
на диаграмме оказываются ломаными в точках фазовых переходов. Точки изломов отмечены для металлов: п – плавление, к – кипение, т – полиморфное превращение; для оксидов металлов: по – плавление, то – полиморфное превращение.
Диаграмма, по сути, представляет сочетание нескольких диаграмм, отображающих зависимости 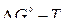 в системах
в системах 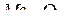 ,
,  и
и 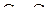 .
.
Дополнительные шкалы на диаграмме связаны с соответствующими указанным системам точками О, Н и С, расположенными на ординате графика. По диаграмме можно определить упругость диссоциации оксидов. Для этого соединяют точку О на диаграмме с точкой на линии 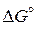 для реакции образования оксида при заданной температуре. Соответствующее равновесное давление кислорода (упругость диссоциации оксида) находим на продолжении этой прямой на шкале
для реакции образования оксида при заданной температуре. Соответствующее равновесное давление кислорода (упругость диссоциации оксида) находим на продолжении этой прямой на шкале 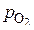 . Диаграмма позволяет также определить условия восстановления чистого металла газовыми смесями СО–СО2 или
. Диаграмма позволяет также определить условия восстановления чистого металла газовыми смесями СО–СО2 или 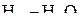 с заданным отношением
с заданным отношением 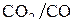 или
или  . Соединяя точки С и Н на ординате нулевого значения температуры с соответствующими значениями отношения
. Соединяя точки С и Н на ординате нулевого значения температуры с соответствующими значениями отношения 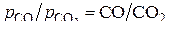 или
или 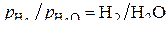 на дополнительных шкалах, получаем линии, пересекающие ломаные прямые
на дополнительных шкалах, получаем линии, пересекающие ломаные прямые 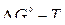 . Точки пересечения соответствуют температурам начала восстановления оксидов газовыми смесями заданного состава. Точки пересечения прямой для реакции
. Точки пересечения соответствуют температурам начала восстановления оксидов газовыми смесями заданного состава. Точки пересечения прямой для реакции 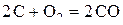 с линиями для оксидов металлов дают значения температур начала восстановления оксидов твердым углеродом и значения
с линиями для оксидов металлов дают значения температур начала восстановления оксидов твердым углеродом и значения 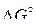 для реакций прямого восстановления оксидов.
для реакций прямого восстановления оксидов.
Обоснование приемов определения условий восстановления с использованием диаграммы можно рассмотреть в следующих примерах.
Пример 1 С помощью диаграммы зависимости 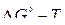 для реакций образования оксидов определить значения равновесных давлений кислорода в системе металл –оксид при температуре 1500 К для систем Fe–FeO,
для реакций образования оксидов определить значения равновесных давлений кислорода в системе металл –оксид при температуре 1500 К для систем Fe–FeO, 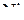 –
–  и
и 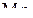 –
– 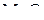 .
.
Решение. На линиях 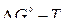 для реакций образования оксидов FeO,
для реакций образования оксидов FeO,  и
и 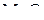 при 1500 К отмечаем точки. Соединяем их прямыми линиямис точкой О, находящейся в верхнем левом углу диаграммы. Прямые проводим до пересечения со шкалой
при 1500 К отмечаем точки. Соединяем их прямыми линиямис точкой О, находящейся в верхнем левом углу диаграммы. Прямые проводим до пересечения со шкалой 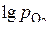 . Получаем следующие значения:
. Получаем следующие значения:
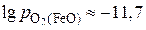 ,
, 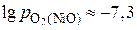 и
и 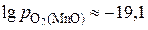 ,
,
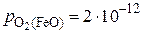 атм,
атм, 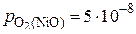 атм и
атм и 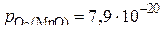 атм.
атм.
Следует отметить, что в соответствии с полученными результатами, определяющими упругости диссоциации данных оксидов, устойчивость оксидов существенно различаются.
Пример 2. С помощью диаграммы зависимости  от температуры для реакций образования оксидов найти равновесное содержание водорода в газовой смеси
от температуры для реакций образования оксидов найти равновесное содержание водорода в газовой смеси  , начиная с которого оксиды FeO,
, начиная с которого оксиды FeO,  и
и  должны восстанавливаться при температуре 1500 К.
должны восстанавливаться при температуре 1500 К.
Решение. На линиях 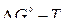 реакций образования оксидов FeO,
реакций образования оксидов FeO,  и
и 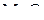 при 1500 К (см. рис. 6) отмечаем точки и соединяем их прямыми линиямисточкой Н на ординате нулевого значения температуры. На шкале
при 1500 К (см. рис. 6) отмечаем точки и соединяем их прямыми линиямисточкой Н на ординате нулевого значения температуры. На шкале 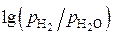 линии дают отметки «0», «–2» и «3,8» соответственно, которые отвечают отношениям
линии дают отметки «0», «–2» и «3,8» соответственно, которые отвечают отношениям 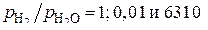 в газовой фазе.
в газовой фазе.
 Рис. 6. Зависимость стандартного изменения энергии Гиббса от температуры для реакций образования оксидов металлов
Рис. 6. Зависимость стандартного изменения энергии Гиббса от температуры для реакций образования оксидов металлов
Учитывая, что 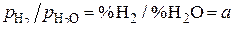 и
и 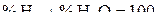 , получаем
, получаем 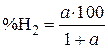 . Подставляя вместо a найденные значения отношений
. Подставляя вместо a найденные значения отношений 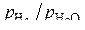 , находим равновесные содержания водорода в газовых смесях, равновесных с Fe–FeO,
, находим равновесные содержания водорода в газовых смесях, равновесных с Fe–FeO, 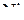 –
–  и
и 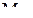 –
– 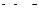 , равные 50, 0,999 и 99,98%.
, равные 50, 0,999 и 99,98%.
Полученные результаты указывают на то, что по сравнению с FeO оксид никеля является легковосстановимым, а оксид 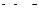 – трудновосстановимым. Оксид марганца восстановить водородом практически невозможно, тогда как наличие следов водорода достаточно для восстановления
– трудновосстановимым. Оксид марганца восстановить водородом практически невозможно, тогда как наличие следов водорода достаточно для восстановления  .
.
Расчеты соответствуют следующим положениям. Виртуальные линии, соединяющие точку Н с отметками на шкале 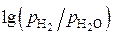 , должны отображать равновесия реакции
, должны отображать равновесия реакции 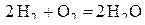 при заданных отношениях
при заданных отношениях 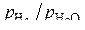 . Можно отметить, что одно из этих равновесий при
. Можно отметить, что одно из этих равновесий при 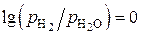 , или
, или 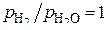 представлено на диаграмме пунктирной линией. Точки пересечения виртуальных линий с прямыми диаграммы для оксидов соответствуют совместному равновесию реакций
представлено на диаграмме пунктирной линией. Точки пересечения виртуальных линий с прямыми диаграммы для оксидов соответствуют совместному равновесию реакций
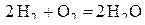 ,
,
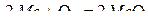 .
.
Разность уравнений этих реакций, записанных на ½ моль О2 приводит к уравнению реакции восстановления 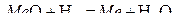 . Поэтому отношение
. Поэтому отношение 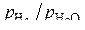 для реакции горения водорода является также равновесным и для реакции восстановления оксида Ме О.
для реакции горения водорода является также равновесным и для реакции восстановления оксида Ме О.
Пример 3. С помощью диаграммы зависимости 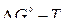 для реакций образования оксидов найти температуры начала восстановления оксидов Cu2O, FeO, Cr2O3, SiO2 и CaO твердым углеродом. Оценить составы газовой смеси
для реакций образования оксидов найти температуры начала восстановления оксидов Cu2O, FeO, Cr2O3, SiO2 и CaO твердым углеродом. Оценить составы газовой смеси 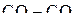 при найденных температурах.
при найденных температурах.
Решение. На диаграмме 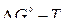 кроме линий для реакций образования оксидов металлов имеется линия для реакции
кроме линий для реакций образования оксидов металлов имеется линия для реакции 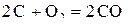 . Уравнение любой реакции прямого восстановления можно представить разностью уравнений реакций
. Уравнение любой реакции прямого восстановления можно представить разностью уравнений реакций
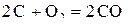 ,
,
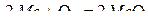 .
.
Совместное равновесие этих реакций на диаграмме должно соответствовать точке пересечения линий для этих реакций и отражать равновесие реакции 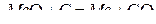 .
.
Таким образом, точка пересечения дает значение температуры начала восстановления оксида твердым углеродом.
Для оксидов Cu2O, FeO, Cr2O3, SiO2 и CaO они равны (см. рис.6): 410, 975, 1515, 1925 и 2385 К при Р = 1 атм соответственно.
Соединив прямой точки пересечения с точкой С на рис.6 и продолжив прямую до шкалы 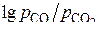 , получаем отметки «–12,6», «0,17», «3,3», «4,8», и «5,5». Они соответствуют значениям
, получаем отметки «–12,6», «0,17», «3,3», «4,8», и «5,5». Они соответствуют значениям 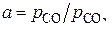 , равным
, равным 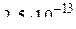 , 1,48, 1995,
, 1,48, 1995, 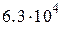 ,
, 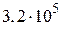 . По выражению
. По выражению 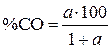 , аналогичному в примере 1,6, вычисляем
, аналогичному в примере 1,6, вычисляем 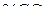 в рассматриваемых системах
в рассматриваемых системах 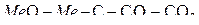 .
.
Концентрации СО в системах с оксидами Cu2O, FeO, Cr2O3 равны 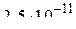 , 60 и 99,9 %, а в системах с SiO2 и CaO практически не отличаются от 100%.
, 60 и 99,9 %, а в системах с SiO2 и CaO практически не отличаются от 100%.
Оценка условий восстановления оксидов металлов
при заданном давлении
Значения 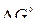 реакций прямого восстановления, найденные аналитически из температурных зависимостей реакций образования оксидов или из диаграммы
реакций прямого восстановления, найденные аналитически из температурных зависимостей реакций образования оксидов или из диаграммы 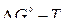 (см. рис. 6) как ординаты точки пересечения линий равновесий, позволяют найти температуры начала восстановления оксидов, соответствующие стандартному общему давлению или парциальному давлению СО, равным 1 атм. При всех других давлениях необходим учет их значений, что можно сделать, применив для анализа и расчета уравнение изотермы химической реакции.
(см. рис. 6) как ординаты точки пересечения линий равновесий, позволяют найти температуры начала восстановления оксидов, соответствующие стандартному общему давлению или парциальному давлению СО, равным 1 атм. При всех других давлениях необходим учет их значений, что можно сделать, применив для анализа и расчета уравнение изотермы химической реакции.
Для реакций прямого восстановления, протекающих при температурах выше 1200…1300 К, представленных в виде 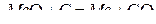 , уравнение изотермы можно записать как
, уравнение изотермы можно записать как
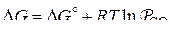 или
или 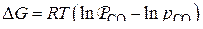 ,
,
где 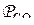 – фактическое давление СО в системе;
– фактическое давление СО в системе; 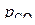 – равновесное давление СО, равное константе равновесия реакции прямого восстановления оксида в системе без растворов.
– равновесное давление СО, равное константе равновесия реакции прямого восстановления оксида в системе без растворов.
Если для расчета 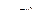 реакции прямого восстановления применять выражение вида
реакции прямого восстановления применять выражение вида 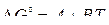 , то температура начала восстановления оксида
, то температура начала восстановления оксида 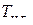 может быть найдена из условия равновесия реакции
может быть найдена из условия равновесия реакции 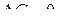 или
или 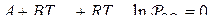 и вычислена из выражения
и вычислена из выражения 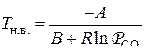 .
.
В соответствии с принципом смещения равновесия Ле-Шателье – Брауна равновесие реакции карботермического восстановления при увеличении давления в случае только одного газообразного реагента СО должно быть смещено в сторону меньшего выхода продуктов. Это означает увеличение устойчивости восстанавливаемого оксида, и поэтому значение 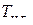 его при увеличении давления должно возрастать. Напротив, уменьшение давления, в том числе и за счет отвода СО из системы (реактора), должно приводить к пониженным значениям температур начала восстановления оксидов.
его при увеличении давления должно возрастать. Напротив, уменьшение давления, в том числе и за счет отвода СО из системы (реактора), должно приводить к пониженным значениям температур начала восстановления оксидов.
 2020-01-14
2020-01-14 419
419








