Восстановление оксидов железаводородом
. В соответствии с диаграммой состояния системы Fe–O и принципом последовательности превращений А.А. Байкова восстановление оксидов железа должно происходить по двум возможным схемам:
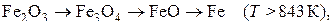
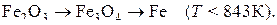
Тогда уравнения реакций восстановления оксидов железа водородом, традиционно называемые реакциями косвенного восстановления, должны быть записаны в виде:
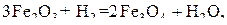 (a)
(a)
 (b)
(b)
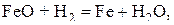 (c)
(c)
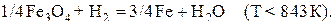 (d)
(d)
По правилу фаз любая из частных систем при наличии только чистых веществ является трехкомпонентной и трехфазной, а потому бивариантной 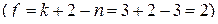 . Это означает, что из четырех переменных:
. Это означает, что из четырех переменных: 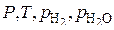 только две оказываются независимыми. Если выбрать в качестве независимых
только две оказываются независимыми. Если выбрать в качестве независимых 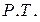 то
то  , то есть если задать температуру и общее давление, то состояние системы определяется решением системы двух уравнений:
, то есть если задать температуру и общее давление, то состояние системы определяется решением системы двух уравнений:
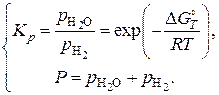
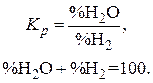

Из последнего уравнения видно, что равновесное содержание водорода в газовых смесях зависит только от температуры, так как температура определяет значения констант равновесия реакций восстановления оксидов железа. В соответствии с принципом смещения равновесия Ле Шателье–Брауна и анализом температурной зависимости константы равновесия химической реакции для эндотермических реакций 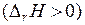 с увеличением температуры возрастают их константы равновесия и уменьшается равновесный
с увеличением температуры возрастают их константы равновесия и уменьшается равновесный  в газовых смесях. Для экзотермических реакций
в газовых смесях. Для экзотермических реакций 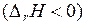 наблюдаются обратные зависимости.
наблюдаются обратные зависимости.
Значения равновесных содержаний 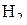 над металло-оксидными смесями приведены в табл. 1 и представлены графически (рис. 1).
над металло-оксидными смесями приведены в табл. 1 и представлены графически (рис. 1).
Таблица 1
Равновесное содержание  в смесях при восстановлении оксидов железа (
в смесях при восстановлении оксидов железа (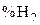 )
)
| T, К | 600 | 800 | 843 | 1000 | 1200 | 1400 |
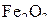
| 5,8·10–4 | 1,1·10–3 | 1,2·10–3 | 1,5·10–3 | 1,9·10–3 | 2,3·10–3 |
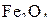
| 92,0 | 75,3 | 71,3 | 35,7 | 12,9 | 5,4 |
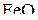
| – | – | 71,4 | 64,8 | 58,4 | 53,6 |
Следует отметить, что в строке таблицы для оксида 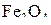 представлены значения концентраций водорода над фазами
представлены значения концентраций водорода над фазами  (Т > 843 К) и
(Т > 843 К) и 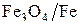 (Т < 843 К). Это обусловлено тем, что оксид
(Т < 843 К). Это обусловлено тем, что оксид 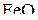 устойчив при
устойчив при  температурах только выше 843 К.
температурах только выше 843 К.
На рис. 1 представлены кривые, характеризующие равновесные состояния трех систем. Обозначения кривых соответствуют уравнениям реакций восстановления оксида (см. упражнение 1). На графике отсутствует кривая для реакции восстановления  . Из таблицы видно, что достаточно лишь следов водорода для восстановления
. Из таблицы видно, что достаточно лишь следов водорода для восстановления  до
до 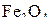 . Для этого равновесия можно отметить рост
. Для этого равновесия можно отметить рост 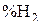 над равновесной смесью
над равновесной смесью 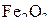 –
– 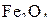 , обусловленный экзотермическим характером реакции (a). Реакции (b) – (d), напротив, эндотермичны, и в соответствии с этим равновесная концентрация
, обусловленный экзотермическим характером реакции (a). Реакции (b) – (d), напротив, эндотермичны, и в соответствии с этим равновесная концентрация  в газовых смесях уменьшается с ростом температуры. На графике даны обозначения областей устойчивого состояния твердых фаз.
в газовых смесях уменьшается с ростом температуры. На графике даны обозначения областей устойчивого состояния твердых фаз.
Для доказательства устойчивого существования оксида или железа в состояниях соответствующей области можно определить направление реакций восстановления оксида, используя уравнение изотермы
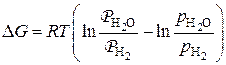 ,
,
где  и
и 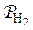 – фактические давления газов в реакторе;
– фактические давления газов в реакторе; 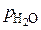 и
и 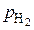 – равновесные давления газов в системе.
– равновесные давления газов в системе.
Для состояний в области выше равновесных кривых c и d справедливо неравенство 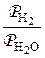 >
> 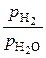 для всех реакций восстановления (так как
для всех реакций восстановления (так как 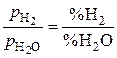 ). Следовательно, для всех реакций (a) – (d), как следует из уравнения изотермы, изменение энергии
). Следовательно, для всех реакций (a) – (d), как следует из уравнения изотермы, изменение энергии 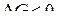 . Это означает, что все реакции должны протекать в прямом направлении, и процессы должны завершиться образованием
. Это означает, что все реакции должны протекать в прямом направлении, и процессы должны завершиться образованием 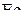 Напротив, для состояний в области ниже равновесной кривой с, но выше кривой b
Напротив, для состояний в области ниже равновесной кривой с, но выше кривой b 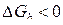 , а
, а 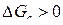 . В этих условиях прямое протекание реакции (b) и обратное – реакции (с) должно привести к образованию
. В этих условиях прямое протекание реакции (b) и обратное – реакции (с) должно привести к образованию 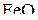 как устойчивого продукта. Аналогично можно показать, что фактические состояния системы в области, ограниченной кривыми d, b и a (отсутствующей и сливающейся с осью температуры), отвечают направлению реакций, завершающихся образованием
как устойчивого продукта. Аналогично можно показать, что фактические состояния системы в области, ограниченной кривыми d, b и a (отсутствующей и сливающейся с осью температуры), отвечают направлению реакций, завершающихся образованием 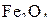 .
.
Состояние, отмеченное на графике точкой пересечения трех кривых d, b и с, соответствует равновесию четырехфазной системы, представленной тремя твердыми 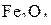 ,
, 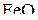 ,
, 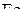 и одной газообразной фазами. Это так называемая тройная точка условно нонвариантного равновесия. Для данного равновесия при Р= const
и одной газообразной фазами. Это так называемая тройная точка условно нонвариантного равновесия. Для данного равновесия при Р= const  правило фаз должно быть записано в виде
правило фаз должно быть записано в виде 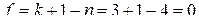 . Так как все реакции a, d, b и с идут без изменения числа моль газообразных реагентов, то давление действительно не влияет на равновесный состав газовой смеси и на положение тройной точки с координатами 843 К и 71,4 % Н2.
. Так как все реакции a, d, b и с идут без изменения числа моль газообразных реагентов, то давление действительно не влияет на равновесный состав газовой смеси и на положение тройной точки с координатами 843 К и 71,4 % Н2.
Рис. 1 с приведенными обозначениями областей может быть назван диаграммой устойчивости железа и его оксидов в системе 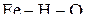 . Диаграмма позволяет выбирать условия протекания процессов в требуемом направлении.
. Диаграмма позволяет выбирать условия протекания процессов в требуемом направлении.
 2020-01-14
2020-01-14 220
220








