В соответствии с диаграммой состояния системы Fe–O и принципом последовательности превращений А.А. Байкова уравнения реакций восстановления оксидов железа монооксидом углерода должны быть записаны в виде:
 (
( )
)
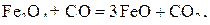 (
( )
)
 (
( )
)
 (
( )
)
По правилу фаз любая из частных систем при наличии только чистых веществ является трехкомпонентной и трехфазной, а потому бивариантной 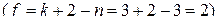 . Это означает, что из 4 переменных:
. Это означает, что из 4 переменных: 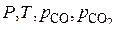 только две оказываются независимыми. Если выбрать в качестве независимых
только две оказываются независимыми. Если выбрать в качестве независимых  то
то  , и состояние системы определяется решением системы двух уравнений:
, и состояние системы определяется решением системы двух уравнений:

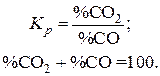

Из последнего выражения видно, что равновесная концентрация монооксида углерода в газовых смесях над твердыми фазами зависит только от температуры, определяющей значения констант равновесия реакций восстановления оксидов железа. Температурные зависимости констант равновесия реакций 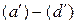 и составов газовых смесей могут быть оценены качественно, если известны знаки тепловых эффектов реакций.
и составов газовых смесей могут быть оценены качественно, если известны знаки тепловых эффектов реакций.
Значения равновесных содержаний  над металло-оксидными смесями приведены в таблице 2 и представлены графически (см. рис. 2). Следует отметить, что в строке таблицы для оксида
над металло-оксидными смесями приведены в таблице 2 и представлены графически (см. рис. 2). Следует отметить, что в строке таблицы для оксида  представлены значения концентраций CO над фазами
представлены значения концентраций CO над фазами  (Т > 843 К) и
(Т > 843 К) и 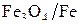 (Т < 843 К). Это обусловлено тем, что оксид
(Т < 843 К). Это обусловлено тем, что оксид 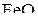 устойчив при температурах только выше 843 К.
устойчив при температурах только выше 843 К.
Таблица 2
Равновесное содержание  в смесях при восстановлении оксидов железа (
в смесях при восстановлении оксидов железа ( )
)
| T, К | 600 | 800 | 843 | 1000 | 1200 | 1400 |

| 2,1·10–5 | 2,4·10–4 | 3,5·10–4 | 1,0·10–3 | 2,7·10–3 | 5,4·10–3 |

| 29,7 | 41,0 | 42,9 | 27,6 | 17,5 | 12,2 |
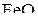
| – | – | 43,0 | 55,9 | 66,8 | 73,7 |
 На рис. 2 представлены кривые, характеризующие равновесные состояния трех систем. Номер кривой соответствует уравнению реакции восстановления оксида (см. упражнение 2). На графике отсутствует кривая для реакции восстановления
На рис. 2 представлены кривые, характеризующие равновесные состояния трех систем. Номер кривой соответствует уравнению реакции восстановления оксида (см. упражнение 2). На графике отсутствует кривая для реакции восстановления  . Из таблицы видно, что достаточно лишь следов монооксида углерода для восстановления
. Из таблицы видно, что достаточно лишь следов монооксида углерода для восстановления  до
до  . Можно отметить увеличение равновесного содержания
. Можно отметить увеличение равновесного содержания  над смесью
над смесью  –
–  , обусловленное экзотермическим характером реакции (
, обусловленное экзотермическим характером реакции ( ). Такой же характер зависимостей для реакций (
). Такой же характер зависимостей для реакций ( ) и (
) и ( ). Эти реакции также экзотермические, что подтверждается отрицательными знаками первых слагаемых в уравнениях для
). Эти реакции также экзотермические, что подтверждается отрицательными знаками первых слагаемых в уравнениях для  и
и  , соответствующих средним значениям тепловым эффектам реакций. Реакция (
, соответствующих средним значениям тепловым эффектам реакций. Реакция ( ), напротив, эндотермична, и в соответствии с этим равновесная концентрация
), напротив, эндотермична, и в соответствии с этим равновесная концентрация  в данной системе уменьшается с ростом температуры. На графике даны обозначения областей устойчивого состояния твердых фаз.
в данной системе уменьшается с ростом температуры. На графике даны обозначения областей устойчивого состояния твердых фаз.
Для доказательства устойчивого существования оксида или железа в состояниях соответствующей области можно определить направление реакций восстановления оксида, используя уравнение изотермы
 ,
,
где  и
и  – фактические давления газов в реакторе;
– фактические давления газов в реакторе;  и
и 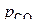 – равновесные давления газов в системе.
– равновесные давления газов в системе.
Анализ диаграммы с помощью уравнения изотермы аналогичен ранее выполненному для системы  (см. пример 1). На рис. 2, как и на предыдущем рис. 1, имеется тройная точка четырехфазного равновесия. Координаты ее: 843 К и 42,3 % СО.
(см. пример 1). На рис. 2, как и на предыдущем рис. 1, имеется тройная точка четырехфазного равновесия. Координаты ее: 843 К и 42,3 % СО.
Рис. 2 с приведенными обозначениями областей называют диаграммой устойчивости железа и его оксидов в системе  . Диаграмма позволяет выбирать условия протекания процессов в требуемом направлении.
. Диаграмма позволяет выбирать условия протекания процессов в требуемом направлении.
 Упражнение 1.3. Воспользовавшись приведенными в таблицах 1 и 2 данными, построить сравнительную диаграмму устойчивости железа и его оксидов в системах
Упражнение 1.3. Воспользовавшись приведенными в таблицах 1 и 2 данными, построить сравнительную диаграмму устойчивости железа и его оксидов в системах  и
и  . Провести анализ равновесий в сравниваемых системах.
. Провести анализ равновесий в сравниваемых системах.
Решение. Диаграмма равновесий в указанных системах, построенная по данным таблиц 1 и 2 как совмещение двух рис. 1 и 2 в один, представлена на рис. 3.
Точки пересечения кривых b и b ’ и кривых с и с ’ принадлежат одной и той же температуре 1093 К, так как они соответствуют константе равновесия реакции водяного газа  , равной единице при 1093 К:
, равной единице при 1093 К:
 .
.
Действительно, при равенстве в точках пересечения кривых b и b ’ и кривых с и с ’ равновесных концентраций 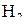 и СO, а значит, отношений
и СO, а значит, отношений  , получаем
, получаем 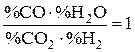 . Левая часть данного выражения соответствует константе равновесия реакции водяного газа и равна единице при подстановке
. Левая часть данного выражения соответствует константе равновесия реакции водяного газа и равна единице при подстановке
Т = 1093 К в известное уравнение температурной зависимости  реакции водяного газа:
реакции водяного газа:  .
.
Из сравнения положений соответствующих линий на рис. 3 видно, что при  лучшим восстановителем является СО, а при
лучшим восстановителем является СО, а при  – водород. Иначе, при
– водород. Иначе, при  для восстановления одного и того же оксида железа допустима меньшая концентрация восстановителя СO по сравнению с
для восстановления одного и того же оксида железа допустима меньшая концентрация восстановителя СO по сравнению с 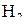 , а при
, а при 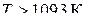 наоборот.
наоборот.
 2020-01-14
2020-01-14 479
479








