Реакции восстановления оксидов металлов твердым углеродом являются наиболее распространенными в руднотермических процессах. В общем случае при углетермическом восстановлении наряду с основными продуктами (металлом или низшим оксидом) могут получаться два оксида углерода СО и СО2. Поэтому могут протекать два вида реакций
Ме О + С = Ме + СО, (I)
2 Ме О + С = 2 Ме + СО2. (II)
Относительное развитие процесса по данным видам реакций определяется взаимодействием
С + СО2 = 2СО. (е)
Каждая реакция прямого восстановления может рассматриваться как суммарная, например,
Ме О + СО = Ме + СО2,
С + СО2 = 2СО,
Ме О + С = Ме + СО
или
×2׀ Ме О + СО = Ме + СО2,
С + СО2 = 2СО,
2 Ме О + С = 2 Ме + СО2.
Таким образом, возможен так называемый косвенный анализ. Термодинамические характеристики реакций прямого восстановления и их константы равновесия могут быть определены путем алгебраического суммирования величин, определяющих термодинамику реакции восстановления оксидов монооксидом углерода и реакции газификации.
С повышением температуры идет смещение равновесия эндотермической реакции (е) в сторону больших концентраций СО, и возрастает роль реакций I-ого вида в восстановлении оксидов углеродом. При температурах 1200–1300 К по равновесию (е) % СО в газовой фазе приближается к 100 % и роль реакций II-ой группы становится весьма малой. Иначе, при температурах пирометаллургических процессов наибольшее значение имеют реакции восстановления углеродом с образованием СО в качестве продукта, но не СО2. Отнятие кислорода от термодинамически устойчивых оксидов, например, MnO, SiO2, Al2O3 за счет углерода может происходить только при высоких температурах. Поэтому при термодинамическом анализе углетермического восстановления таких оксидов можно учитывать только реакции первого вида с образованием одного оксида углерода СО.
В соответствии с диаграммой состояния системы Fe–O и принципом последовательности превращений А.А. Байкова уравнения реакций восстановления оксидов железа твердым углеродом должны быть записаны в виде двух систем:
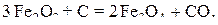
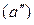
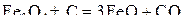
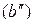
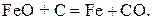
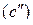
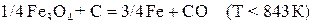
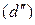
и
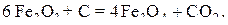
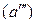
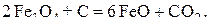
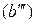
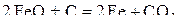
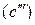
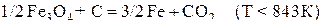 .
. 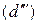
Относительный вклад углерода как восстановителя во взаимодействия 1-ой и 2-ой систем определяется развитием реакции газификации углерода
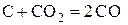 . (e)
. (e)
При наличии твердого углерода в системе Fe–С–O и вотсутствии растворов любая из частных систем, представленная одной из реакций 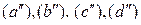 ,
, 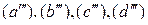 , является трехкомпонентной и четырехфазной, а потому моновариантной
, является трехкомпонентной и четырехфазной, а потому моновариантной 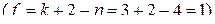 . Это означает, что из переменных:
. Это означает, что из переменных: 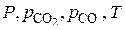 только один параметр является независимым. Если выбрать в качестве независимого
только один параметр является независимым. Если выбрать в качестве независимого 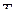 то для реакций первой системы
то для реакций первой системы 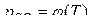 , что подтверждается выражением
, что подтверждается выражением 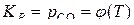 . Для реакций второй системы зависимость
. Для реакций второй системы зависимость 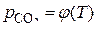 также подтверждается выражением
также подтверждается выражением 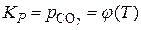 . То есть состояние данных частных систем определяется только температурой.
. То есть состояние данных частных систем определяется только температурой.
Для более общих систем, например, системы, представленной реагентами 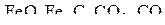 и четырьмя реакциями
и четырьмя реакциями 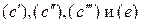 , из которых только две независимые, моновариантность подтверждается при анализе системы трех уравнений связи.
, из которых только две независимые, моновариантность подтверждается при анализе системы трех уравнений связи.
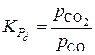 , (7)
, (7)
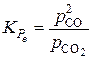 , (8)
, (8)
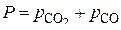 . (9)
. (9)
Решение ее относительно Р можно выполнить следующим образом. Запишем уравнение (9) в виде 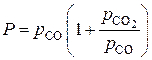 и введем в него замены из уравнений (7) и (8), записав
и введем в него замены из уравнений (7) и (8), записав 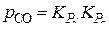 . Получаем
. Получаем
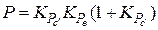 . (10)
. (10)
Выражение (10) указывает на однозначную зависимость Р от Т.
Состав газовой фазы для рассматриваемой системы может быть найден из выражения 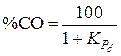 , получаемого из уравнения (7) при замене парциальных давлений концентрациями газов в % (об.).
, получаемого из уравнения (7) при замене парциальных давлений концентрациями газов в % (об.).
Введя в правило фаз условие нонвариантности системы Fe–С–O ( )
)
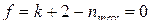 , определяем, что возможно пятифазное ее состояние, то есть одновременное сосуществование четырех твердых (
, определяем, что возможно пятифазное ее состояние, то есть одновременное сосуществование четырех твердых (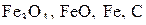 ) и газовой (
) и газовой (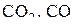 ) фаз. Оксид
) фаз. Оксид 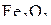 может находиться в равновесии только с
может находиться в равновесии только с 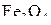 и С в присутствии
и С в присутствии 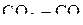 , и с его участием пятифазная система не реализуется.
, и с его участием пятифазная система не реализуется.
Условия равновесия оксидов железа с твердым углеродом в газовой фазе представлены графически на рис. 4.
На графике отсутствует кривая равновесия 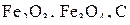 с газовой фазой. Условия этого равновесия (см. табл. 3) соответствуют весьма высоким давлениям, нехарактерным для обычных руднотермических процессов и без графической иллюстрации указывают на ничтожно низкую устойчивость
с газовой фазой. Условия этого равновесия (см. табл. 3) соответствуют весьма высоким давлениям, нехарактерным для обычных руднотермических процессов и без графической иллюстрации указывают на ничтожно низкую устойчивость 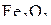 в присутствии твердого углерода. Кривые 1–3 разделяют области устойчивого существования различных оксидов железа при наличии твердого углерода. Эти кривые сходятся в одной так называемой пятерной точке нонвариантного пятифазного равновесия: газ
в присутствии твердого углерода. Кривые 1–3 разделяют области устойчивого существования различных оксидов железа при наличии твердого углерода. Эти кривые сходятся в одной так называемой пятерной точке нонвариантного пятифазного равновесия: газ 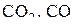 и
и 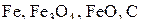 .
.
Координаты этой точкиимеют значения 843 К и 0,125 атм. Содержание СО равно 42,8 % (об.). Диаграмма с нанесенными обозначениями устойчивых конечных состояний позволяет быстро установить, какие превращения должен претерпевать оксид железа в присутствии твердого углерода и каково конечное состояние системы.
Например, при давлении 1 атм можно отметить две характерные температуры Т 1 и Т 2. При Т < Т 1 в равновесии с твердым углеродом устойчив магнетит 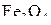 . При Т 1 начинается его восстановление до
. При Т 1 начинается его восстановление до 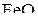 . При Т 1 < Т < Т 2 оксид
. При Т 1 < Т < Т 2 оксид 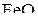 не восстанавливается углеродом, но при Т > Т 2 оксид
не восстанавливается углеродом, но при Т > Т 2 оксид 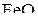 взаимодействует с углеродом и восстанавливается до металлического железа.
взаимодействует с углеродом и восстанавливается до металлического железа. 
Термодинамический анализ условий восстановления оксидов железа твердым углеродом возможен на основе совместного графического представления зависимостей 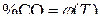 для реакций косвенного восстановления оксидов железа монооксидом углерода и реакции газификации углерода.
для реакций косвенного восстановления оксидов железа монооксидом углерода и реакции газификации углерода.
На график, представленный на рис. 2, нанесем изобару реакции газификации углерода, соответствующую равновесию при 1 атм реакции
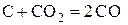 . (e)
. (e)
Для ее построения используем результаты расчета 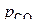 по уравнению
по уравнению
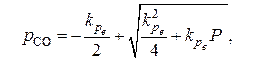 (11)
(11)
полученному при решении системы уравнений:
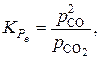
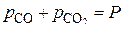 .
.
Константу равновесия реакции (e) вычисляем из известного выражения
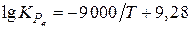
Равновесные концентрации СО определяем из соотношения 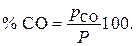
Результаты расчета заносим в табл. 4 и строим график (см. рис. 5).
Таблица 4
Результаты расчета равновесного состава газа в системе С–О
| T, К | 600 | 800 | 843 | 1000 | 1200 | 1400 | 903 | 943 |
| KP | 1,90E-06 | 0,011 | 0,040 | 1,906 | 60,30 | 711,1 | 0,2 | 0,5 |
| % СО | 0,14 | 9,83 | 18,13 | 72,45 | 98,39 | 99,86 | 36,11 | 51,58 |
 На рис. 5 представлены равновесные кривые реакций восстановления
На рис. 5 представлены равновесные кривые реакций восстановления 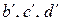 (см. пример 2) и реакции газификации углерода (e) при Р = 1 атм. На данной диаграмме в отличие от предыдущей для этой же системы Fe–С–O при наличии твердого углерода (см. рис.4) области устойчивого существования оксидов железа разделяют не кривые равновесий реакций, а пунктирные прямые, соответствующие температурам Т 1 и Т 2. Значения этих температур совпадают с ранее найденными 903 и 943 К (см. пример 3).
(см. пример 2) и реакции газификации углерода (e) при Р = 1 атм. На данной диаграмме в отличие от предыдущей для этой же системы Fe–С–O при наличии твердого углерода (см. рис.4) области устойчивого существования оксидов железа разделяют не кривые равновесий реакций, а пунктирные прямые, соответствующие температурам Т 1 и Т 2. Значения этих температур совпадают с ранее найденными 903 и 943 К (см. пример 3).
На диаграмме выявляются две точки 1 и 2 равновесных состояний в системах: 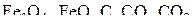 (точка 1) и
(точка 1) и 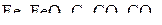 (точка 2). Результаты расчета равновесных концентраций СО в газовых фазах при Т 1 и Т 2 представлены также в табл. 4.
(точка 2). Результаты расчета равновесных концентраций СО в газовых фазах при Т 1 и Т 2 представлены также в табл. 4.
При всех других условиях реагенты реакций восстановления оксидов железа твердым углеродом в равновесии не находятся – идут процессы с образованием одного из устойчивых веществ: 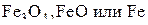 .
.
Существование указанных границ стабильного состояния железа и его оксидов связано с тем, что при наличии в системе твердого углерода состав газовой фазы определяется состояниями, соответствующими точкам кривой (e). При Т < Т 1 концентрация СО в газовой фазе, определяемая точками нижней ветви кривой (e), меньше необходимой для прямого протекания реакций 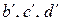 . Поэтому устойчивым в этих условиях оказывается только магнетит
. Поэтому устойчивым в этих условиях оказывается только магнетит 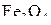 . Железо и
. Железо и 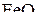 в присутствии твердого углерода окисляются в этих условиях до
в присутствии твердого углерода окисляются в этих условиях до 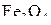 независимо от исходного состава газовой фазы
независимо от исходного состава газовой фазы 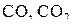 . При Т 1 < Т < Т 2 концентрация СО в газовой фазе, определяемая точками ветви 1–2 кривой (e), меньше необходимой для прямого протекания реакции
. При Т 1 < Т < Т 2 концентрация СО в газовой фазе, определяемая точками ветви 1–2 кривой (e), меньше необходимой для прямого протекания реакции 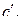 но больше равновесной для реакции
но больше равновесной для реакции 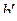 . Поэтому конечным продуктом протекания обеих реакций должен быть оксид
. Поэтому конечным продуктом протекания обеих реакций должен быть оксид 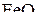 . При Т > Т 2 создаются условия для прямого протекания реакций
. При Т > Т 2 создаются условия для прямого протекания реакций 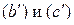 , завершающегося образованием металлического железа.
, завершающегося образованием металлического железа.
Можно отметить, что если на график нанести изобару для давления ниже 1 атм, то она расположится выше приведенной на рис 5. В соответствии с этим области устойчивости железа и его оксидов сместятся влево, в сторону меньших температур начала прямого восстановления 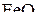 и
и 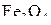 .
.
 2020-01-14
2020-01-14 1246
1246








