Алкены – непредельные углеводороды, с общей формулой  , в молекулах содержится одна двойная связь.
, в молекулах содержится одна двойная связь.
CH2=CH2 CH2=CH–CH3 CH3–CH=CH–CH3 CH3=CH–CH–CH3
этилен (этен) пропилен (пропен) бутен–2 бутен–1
Двойная связь состоит из двух: прочной σ - связи (по линии соединяющей центры атомов углерода) и менее прочной π - связи (за счёт перекрывания p - орбиталей атома углерода вне σ - связи).
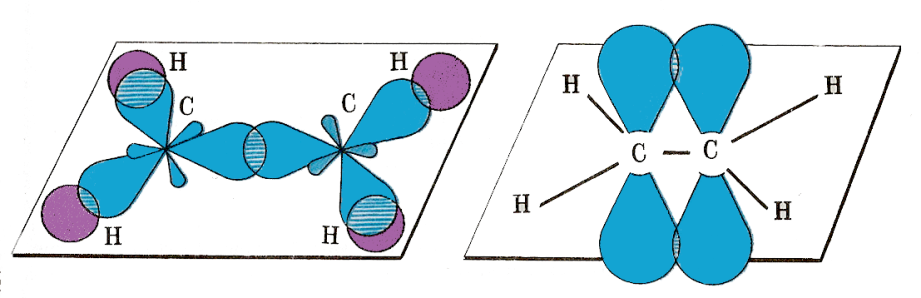 Атомы углерода, образующие двойную связь, находятся в состоянии sp2–гибридизации, три гибридные орбитали находятся в плоскости под углом 120°, а перпендикулярно к ним находятся не гибридные p - орбитали,
Атомы углерода, образующие двойную связь, находятся в состоянии sp2–гибридизации, три гибридные орбитали находятся в плоскости под углом 120°, а перпендикулярно к ним находятся не гибридные p - орбитали,
которые и образуют σ - связь.
Часть молекулы, соединяющая π-связь, имеет плоскую структуру, а остальная – зигзагообазная. Для алкенов характерны виды изомерии (С4Н8):
· 
 положение двойной связи: и
положение двойной связи: и
· 
 разветлённость скелета:
разветлённость скелета:

· цис- транс- изомерия:
· межклассовая (с циклоалканами)
Химические свойства (обусловлены наличием π-связи):
· Присоединение водорода и галогенов:
СH2=СН2 + Н2  CH3–СН3 Н2С=СН2 + Br2
CH3–СН3 Н2С=СН2 + Br2  BrCH2–CH2Br
BrCH2–CH2Br
этилен этан качественная реакция на двойную связь
2) Присоединение воды:
Н2С=СН2 + НОН  СН3–СН2–ОН
СН3–СН2–ОН
этиловый спирт
3) Окисление:
а) полное (горение) б) частичное
C2H2 + 3O2  2CO2 + 2H2O Н2С=СН2 + O + Н2О
2CO2 + 2H2O Н2С=СН2 + O + Н2О  OH–СН2–СН2–OH
OH–СН2–СН2–OH
этиленгликоль
Качественная реакция обесцвечивание розового раствора KMgO2
n CH2=CH2  [–CH2–CH2–] n
[–CH2–CH2–] n
полиэтилен
Билет №3 (1)
Виды химической связи(ионная, металлическая, водородная, ковалентная - полярная, и неполярная).
Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
| Основные типы химической связи | ||||
| Ионная | Ковалентная | Металлическая | Водородная | |
| Связь, которая возникает, когда одни атомы почти полностью отдают, а другие присоединяют валентные электроны. | Связь, возникающая за счёт образования общих электронных пар. | Связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической кристаллической решётке. | Связь между атомами водорода одной молекулы и элементом с высокой ЭО (O, N, F) другой молекулы. | |
| неполярная | полярная | |||
| Связь, между атомами с одинаковой ЭО. | Связь между атомами, ЭО которых различается незначительно. | |||
| Na – 1e– → Na+ Cl + 1e– → Cl– Na+Cl– | H + H → H H F + F → F F | H + F → Hδ+ Fδ– | ||
| Кристаллические вещества с высокими температурами плавления | Газообразные, жидкие и твёрдые вещества. | Жидкие и газообразные вещества | Твёрдые вещества, ковкие, электро и теплопроводники | Жидкие и твёрдые вещества |
| NaF, KCl | F2, Br, алмаз, графит | HF | Na, Al, Cu, сплавы | HF, H2O, спирты |
Билет №3 (2)
 2020-04-07
2020-04-07 1151
1151








