- это производные предельных углеводородов - алканов, в которых 2 атом водорода (Н) замещены на карбоксильные группы –СООН.
Общая формула: СnН2n (СОOH)2
В щавеле, а также в ревене, кислице, шпинате содержится щавелевая кислота НООС—СООН. Эта простейшая двухосновная кислота — продукт распада некоторых аминокислот, например глицина. При нарушениях обмена веществ (в частности, при недостатке витамина В12) в организме человека откладывается её малорастворимая кальциевая соль — оксалат кальция, это и есть так называемое оксалатное отложение солей.
Янтарная кислота НООС—СН2СН2—СООН впервые была выделена алхимиками. Ещё Агрикола наблюдал при прокаливании янтаря образование похожего на соль белого налёта янтарной кислоты (лат. sal succini volatile — «летучая янтарная соль»).
Получение:
[O]

 СН2 – СН2 → CООН
СН2 – СН2 → CООН
 |
ОН ОН СООН
Щавелевая кислота под действием высоких температур разлагается на муравьиную кислоту и углекислый газ:
 СООН t
СООН t
→ НСООН + СО2 ↑
СООН
Соли щавелевойкислоты называются оксалатами.
ОКСИКИСЛОТЫ - - это производные предельных углеводородов - алканов, в которых кроме карбоксильных групп –СООН содержатся 1 или несколько гидроксильных групп – ОН.
 Общая формула: R - (СОOH)n
Общая формула: R - (СОOH)n
(OH)n
Представители:
Н3С – СН – СООН - молочная, 2-оксипропановая, α- оксипропионовая

ОН
 яблочная, 2-оксибутандиовая, α-оксибутандиовая кислота
яблочная, 2-оксибутандиовая, α-оксибутандиовая кислота
 СООН
СООН
 СН – ОН - винная, 2,3 – диоксибутановая, α, β – диоксимасляная кмслота
СН – ОН - винная, 2,3 – диоксибутановая, α, β – диоксимасляная кмслота
 СН – ОН
СН – ОН
СООН
ОН

 НООС – СН2 – С – СН2 – СООН - лимонная, 3- оксипентантриовая кислота
НООС – СН2 – С – СН2 – СООН - лимонная, 3- оксипентантриовая кислота
СООН
Виды изомерии:
- изомерия углеродного скелета
- изомерия положения группы –ОН
- пространственная (оптическая) изомерия – характерна для ассиметрических кислот:
Простейшим примером может служить молекула молочной (2-гидроксипропановой) кислоты: СН3СН(ОН)СООН.

D+ молочная L - молочная
Оптические изомеры молочной кислоты.
D – от лат. dexter – «правый» L – от лат. laevus – «левый»
Многие соединения не содержат асимметрических атомов углерода, но обнаруживают тем не менее явление оптической изомерии. Условия для изомерии такого типа возникают в случае, когда вращение фрагментов молекулы относительно друг друга затруднено.
Изомеры молочной кислоты:
- не вращаются – молочные продукты, квашенная капуста
- правое вращение – в мышцах животных и человека
- левое вращение – при молочнокислом брожении сахаров
Рацематы – это изомеры, которые имеют компоненты вращения, но не вращаются, т.к. правостороннее и левостороннее вращение скомпенсированы.
Для оксикислот характерны все химические свойства присущие карбоновым кислотам и спиртам.
Специфические свойства оксикарбоновых кислот:
t, мин.к-та
1. Н3С – СН – СООН → СН3СОН + НСООН
 |
ОН
2. Н3С – СН – СООН → СН2=СН – СООН + Н2О
 акриловая
акриловая
ОН
 3. НО- СН2 – СН2 – СН2 –СООН → СН2 – СН2 \
3. НО- СН2 – СН2 – СН2 –СООН → СН2 – СН2 \
О

 СН2 - С /
СН2 - С /
О
циклический внутримолекулярный
сложный эфир (лактон)
Отдельные представители:
Яблочная кислота - существует в виде 2 стереоизомеров и рацемата; бесцветные кристаллы, температура плавления D-изомера- 130,8°С, температура плавления L-изомера- 100°С.
Соли и эфиры яблочной кислоты называются малатами.
α-яблочная кислота содержится в кислых плодах (незрелых яблоках, крыжовнике, плодах рябины, в виде кальциевой соли – в табаке).
Характерные химические свойства яблочной кислоты:
100 °С
1. → ангидрид
140-150 °С
2. → НООС – С – Н + Н2О
 |  |
Н – С – СОН
фумаровая к-та
180 °С
3. → фумаровая к-та + малеиновый ангидрид

 (Н – С – СООН - малеиновая к-та)
(Н – С – СООН - малеиновая к-та)
Н – С – СООН
Н2О2, КМnО4
4. → оксалилуксусная к-та
Н2SО4
5. → кумалиновая к-та
Применение:
- при производстве вин, фруктовых вод, кондитерских изделий как регулятор кислотности;
- в медицине: слабительное средство, от хрипоты;
- входит в состав косметических препаратов.
Винная кислота - в 1769 г. Шееле при действии серной кислотой на винный камень впервые получил винную кислоту НООС—СН(ОН)СН(ОН)—СООН. Впоследствии выяснилось, что винная кислота существует в виде трёх стереоизомеров. Два из них обладают одинаковыми физическими свойствами, а их молекулы представляют собой зеркальные отражения друг друга (оптические антиподы, или энантиомеры). Это так называемые D- и L-винные кислоты, а винный камень — соль D-формы.
Интересно, что энантиомерные винные кислоты образуют кристаллы, которые также являются зеркальными отражениями друг друга. Смесь равных количеств D- и L-винных кислот (рацемат) называется виноградной кислотой. А вот третья из винных кислот — мезовинная не относится к числу оптически активных веществ.
СООН СООН СООН
 |  |  |
Н – С – ОН НО – С – Н Н – С – ОН
 |  |  |
НО – С – Н Н – С – ОН Н – С – ОН
 |  |  |
СООН СООН СООН
D-винная L-винная мезовинная
Эфиры и соли винной кислоты называются тартратами.
Применение:
- тартрат аммония- разрыхлитель теста, компонент паст для печатчния по шёлковым и шерстяным тканям;
- тартрат натрия- эмульгатор в сыроваренной промышленности, в производстве лекарственных средств;
- гидротартрат натрия – в производстве шипучих напитков
Гомологом щавелевой кислоты является адипиновая кислота НООС(СН2)4СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон.
Высшие кислоты, например стеариновая СН3(СН2)16СООН и пальмитиновая СН3(СН2)14СООН, впервые выделенная из пальмового масла, представляют собой бесцветные твёрдые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически — каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот — стеарат натрия C17H35COONa и пальмитат натрия C15H31COONa: они являются основными компонентами мыла.
۩ Интересно знать
Многие карбоновые кислоты — например, яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы и в результате некоторых других биохимических процессов. Плоды цитрусовых богаты лимонной кислотой: в мякоти апельсина её около 2%, в грейпфруте — до 3%, а в лимоне — 6%. Поэтому неудивительно, что впервые она была выделена Шееле в 1784 г. именно из лимонов. Подобный эксперимент можно проделать и в школьной лаборатории: нужно лимонный сок обработать известью, а продукт этой реакции — кальциевую соль отфильтровать и разложить серной кислотой. Образующаяся в результате лимонная кислота переходит в раствор, который упаривают до начала кристаллизации.
ОПОРНЫЙ КОНСПЕКТ
По теме: «УГЛЕВОДЫ»
- это органические соединения, состав которых выражается формулой Сn(H2O)m (n и m ≥ 4).
Исключение составляет рамноза – С6Н12О5 .
ИСТОРИЯ ОТКРЫТИЯ УГЛЕВОДОВ
Сахароза (тростниковый сахар) была хорошо известна на Древнем Востоке. Её выделяли из сока сахарного тростника, который сгущали и с помощью молока осветляли, а затем промывали известковой водой или раствором золы. Примеси отделялись вместе с образующейся пеной. Сахарный сироп заливали в формы, он медленно кристаллизовался в них, превращаясь в большие куски сахара — сахарные головы. Родиной сахарного тростника считается Индия (слово «сахар» тоже «родом» из Индии: «сакхара» на языке одного из древних народов полуострова означало сначала просто «песок», а затем — «сахарный песок»). Из Индии это растение было вывезено в Египет и Персию; оттуда через Венецию сахар поступал в европейские страны. Долгое время он стоил очень дорого и считался роскошью. Поисками более доступных природных источников сахара занимался немецкий химик Андреас Сигизмунд Маргграф. В трактате, изданном в 1747 г., он описал свои опыты по получению сахара из свёклы. К концу XVIII в. в Германии вывели сорт свёклы с повышенным содержанием сахара — сахарную свёклу. В 1796—1802 гг. ученик Маргграфа Франц Карл Ахард (1753—1821) разработал способ выделения сахара из свёклы, положивший начало производству сахара не из привозного тростника, а из местного сырья. Постепенно из дорогого лакомства сахар превратился в дешёвый и доступный каждому продукт питания.
Фруктоза была впервые выделена из «медовой воды» в 1792 г. русским химиком Товием Егоровичем Ловицем, а глюкоза открыта в 1802 г. Химия полисахаридов получила развитие после того, как в 1811 г. русский химик Константин Сигизмундович Кирхгоф впервые осуществил гидролиз крахмала.
Классификация:
все известные углеводы можно подразделить на 2 большие группы - простые и сложные.
1. Простые углеводы – моносахариды (монозы) – являются полигидроксикарбонильными соединениями, не способными при гидролизе образовывать более простые углеводные молекулы. Если моносахариды содержат альдегидную группу, то они относятся к классу альдоз (альдегидоспиртов), если кетонную – к классу кетоз (кетоноспирты). Взависимости от числа углеродных атомов в молекуле моносахаридов различают триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т.д.
Альдозы Кетозы





 СН2 – СН – СОН триозы СН2 – С – СН2
СН2 – СН – СОН триозы СН2 – С – СН2
ОН ОН ОН О ОН







 СН2 – СН – СН – СОН тетрозы СН2 – СН – С – СН2
СН2 – СН – СН – СОН тетрозы СН2 – СН – С – СН2
ОН ОН ОН ОН ОН О ОН









 СН2 – СН – СН – СН – СОН пентозы СН2 – СН – СН – С – СН2
СН2 – СН – СН – СН – СОН пентозы СН2 – СН – СН – С – СН2
ОН ОН ОН ОН ОН ОН ОН О ОН











 СН2 – СН – СН – СН – СН – СОН гексозы СН2 – СН – СН – СН – С – СН2
СН2 – СН – СН – СН – СН – СОН гексозы СН2 – СН – СН – СН – С – СН2
ОН ОН ОН ОН ОН ОН ОН ОН ОН О ОН
Наиболее часто в природе встречаются пентозы и гексозы.
2. Сложные углеводы: в зависимости от степени полимеризации их подразделяют на низкомолекулярные – дисахариды, высокомолекулярные – полисахариды. Дисахариды по способности восстанавливать ионы металлов делят на восстанавливающие и невосстанавливающие. Полисахариды в зависимости от состава можно также разделить на 2 группы: гомополисахариды (построены из моносахаридных остатков одного типа) и гетерополисахариды (построены из остатков разных моносахаридов).
МОНОСАХАРИДЫ
Каждая молекула моносахарида содержит несколько гидроксильных групп и одну карбонильную группу. Большинство моносахаридов — бесцветные кристаллические вещества, прекрасно растворимые в воде. Глюкоза содержится в растительных и животных организмах, в особенности велико ее содержание в виноградном соке (отсюда и название - виноградный сахар), в меде, а также в спелых фруктах и ягодах. Многие моносахариды очень трудно выделить из раствора в виде кристаллов, так как они образуют вязкие растворы (сиропы), состоящие из различных изомерных форм.
Самый известный моносахарид — виноградный сахар, или глюкоза (от греч. «гликис» — «сладкий»), С6Н12О6. Глюкоза принадлежит к классу альдегидоспиртов — соединений, содержащих гидроксильные и альдегидные группы. В молекуле глюкозы пять гидроксильных групп и одна альдегидная. Формулу глюкозы обычно приводят в сокращённом виде:

Общая формула: СnH2nOn
Моносахариды существуют не только в виде линейных форм, но и в виде циклических; эти формы способны переходить одна в другую в водных растворах.
Динамическое равновесие между структурными изомерами называется таутомерией. 
пиранозная форма альдегидная форма
по Хеуорсу по Фишеру
Образование циклических форм моносахаридов происходит в результате реакции внутримолекулярного присоединения гидроксильной группы - ОН к карбонильной –СН2. Наиболее устойчивыми являются 5- и 6 – членные циклы. 5-членные- фуранозные, 6-членные – пиранозные. Сущность таутомерного перехода альдегидной формы в цикли-ческую заключается в перемещении водородного атома от гидроксила при пятом углеродном атоме к кислороду карбонильной группы. В результате этого углеродный атом С-1 становится асимметрическим, а между атомами С-1 и С-5 устанавливается связь через атом кислорода (отсюда название окисная форма) с образованием шестичленного цикла. Эта связь называется глюкозидной. Вновь возникший асимметрический углеродный атом С-1 может иметь две антиподных конфигурации: в этом различие между α- и β-глюкозой.
Глюкоза (а также любой другой из семи изомерных ей сахаров) может существовать в виде двух оптических изомеров, молекулы которых являются зеркальным отображением друг друга — D- и L-форм. Интересно, что в природных соединениях обнаружен только D-изомер глюкозы, в отличие от аминокислот, которые встречаются в природе только в L-форме.
Фруктоза (фруктовый сахар) изомерна глюкозе, но в отличие от неё относится к кетоспиртам — соединениям, содержащим кетоновые и карбонильные группы. Подобно глюкозе, фруктоза легко образует циклические полуацетали, только состоят они преимущественно из пятичленных циклов:

В щелочной среде её молекулы способны изомеризоваться в глюкозу, поэтому водные растворы фруктозы восстанавливают гидроксид меди (II) и оксид серебра (реакция «серебряного зеркала»).
Способы получения глюкозы:
1. В процессе фотосинтеза:
hν, хлорофилл
6СО2 + 6Н2О → С6Н12О6 + 6О2
глюкоза
Источником углеводов в природе служит процесс фотосинтеза —превращение в зеленых листьях растений углекислоты воздуха в углеводы. Энергию для этого процесса дает солнечный свет. Фотосинтез служит единственным источником органических веществ в природе, поскольку животные не способны синтезировать органические вещества из неорганических, они лишь перерабатывают органические вещества, накопленные растениями. Велика роль продуктов фотосинтеза и в качестве источников энергии в промышленности, поскольку и каменный уголь, и нефть, и газ, и тем более древесина — все это «консервированная солнечная энергия», накоп-
ленная за счет процесса фотосинтеза.
2. Частичное окисление спиртов

СН2ОН
 |
Н – С – ОН
 |
НО – С – Н
 |
Н – С – ОН + [O]

Н – С – ОН

СН2ОН
сорбит глюкоза
3. В промышленности глюкоза получают гидролизом крахмала (в присутствий кислот), а также из древесины
Химические свойства:
Строение глюкозы выведено на основе изучения ее химических свойств. Так глюкоза проявляет свойства присущие:
а) спиртам - образует с металлами алкоголяты (сахараты), сложный уксусный эфир, содержащий 5 кислотных остатков (по числу гидроксильных групп). Следовательно, глюкоза - многоатомный спирт;
б) альдегидам - с аммиачным раствором оксида серебра она дает реакцию " серебряного зеркала ". Следовательно, глюкоза - альдегидоспирт, ее молекула может иметь строение.
Однако не все свойства глюкозы согласуются с ее строением как альдегидоспирта.
1. Реакция, доказывающая, что глюкоза имеет альдегидную группу – реакция «серебряного зеркала»:
 О ОН
О ОН


t,NН4ОН
+ Ag2О → + 2 Ag↓
В результате реакции из глюкозы образуется глюконовая кислота и наблюдаем образование на стенках пробирки серебряного налёта.
2. Реакция, доказывающая, что глюкоза является многоатомным спиртом:

СН2ОН

 Н – С – ОН
Н – С – ОН
НО-
 + Сu ↓ → НО – С – Н
+ Сu ↓ → НО – С – Н
НО- + Н2О
Н – С – О \
 осадок Сu
осадок Сu
голубого цвета
Н – С – О ⁄
 |
СН2ОН
раствор тёмно-синего цвета

В щелочной среде соли меди (II) образуют с глюкозой ярко окрашенные комплексы (1). При нагревании эти комплексы разрушаются: глюкоза восстанавливает медь до жёлтого гидроксида меди (I) CuОН, который превра-щается в красный оксид Сu2О (II).
3. Реакция гидрирования (восстановления):
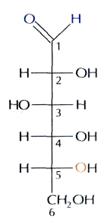 О Н2 ОН
О Н2 ОН

t,Pt
+Н2 →
В результате реакции образуется сорбит
- Этерификация:

СН2 – О – СО – СН3
 |
Н – С – О – СО – СН3
 t,H2SO4
t,H2SO4
 + 5 СН3СООН ↔ СН3 – СО – О – С – Н
+ 5 СН3СООН ↔ СН3 – СО – О – С – Н
Н – С – О – СО – СН3

Н – С – О – СО – СН3
 |
СН2 – О – СО – СН3
В результате реакции образуется пентаацетилглюкоза – сложный эфир глюкозы и уксусной кислоты.
5. Брожение:
1) спиртовое брожение:
f дрожжей
С6Н12О6 → 2 С2Н5ОН + 2 СО2 ↑
2) молочнокислое брожение:
f живых клеток
 С6Н12О6 → 2 СН3 – СН - СООН
С6Н12О6 → 2 СН3 – СН - СООН
ОН
3) маслянокислое брожение:
f живых клеток
С6Н12О6 → СН3 – СН2 – СН2 – СООН + 2 СО2 ↑ + 2Н2 ↑
4) лимоннокислое брожение:
 ОН
ОН
f живых клеток
 С6Н12О6 → СООН – СН2 – С – СН2 – СООН + 2 Н2О
С6Н12О6 → СООН – СН2 – С – СН2 – СООН + 2 Н2О
СООН
лимонная кислота
Глюкоза широко распространена в природе. Её много в спелых фруктах и ягодах, а также в мёде. В связанном виде она входит в состав дисахарида — сахарозы и полисахаридов — крахмала и целлюлозы.
Глюкоза - ценное питательное вещество. При окислении ее в тканях освобождается энергия, неоходи-мая для нормальной жизнедеятельности.
Глюкоза применяется: в медицине, в кондитерском производстве, в производстве зеркал и игрушек (серебрение). Ею пользуется при крашений и аппретировании тканей и кожи.
Фруктоза — самый сладкий из сахаров. Она содержится в мёде (около 40%), нектаре цветов, клеточном соке некоторых растений.
Другие моносахариды:
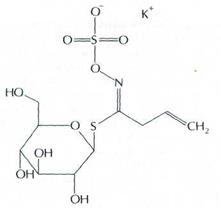
Строение гликозида синигрина, содержащегося в семенах горчицы и хрене. Он состоит из фрагмента D-глюкозы и калиевой соли сероорганического соединения, которое придаёт хрену и горчице характерный жгучий вкус.
Ксилоза («древесный сахар») — составная часть
полисахарида ксилана, сопровождающего целлюлозу в соломе,
кукурузных стеблях, хлопке; арабиноза, встречающаяся в расте-
ниях в виде полисахарида арабана, входящего в состав вишневого клея, аравийской камеди (отсюда и название арабиноза); рибоза, имеющая исключительное биологическое значение из-за своей связи с нуклеиновыми кислотами; манноза — составная часть полисахаридов маннанов; галактоза, входящая в состав дисахарида лактозы — молочного сахара, содержащегося в молоке млекопитающих.
ДИСАХАРИДЫ
- углеводы. которые при гидролизе распадаются на 2 молекулы моносахаридов.
Соединения, построенные из небольшого числа моносахаридов, называют олигосахаридами (от oligos – мало).
Дисахариды по восстановительной способности делят на:
- восстанавливающие- способны вступать в реакции окисления (мальтоза, лактоза, целлобиоза);
- невосстанавливающие- не способны вступать вреакции окисления (сахароза).
Различают два структурных типа дисахаридов, различие между которыми зависит от того, участвуют ли в создании связи оба гликозидных гидроксила или один гликозидный и один спиртовой. В дисахаридах такого типа нет свободных гликозидных гидроксилов. Это значит, что они не способны переходить в таутомерную альдегидную форму, а следовательно, не способны вступать в свойственные этой форме реакции. Не дают дисахариды гликозидно-гликозидного типа, в частности, и столь характерной для моносахаридов реакции серебряного зеркала, не восстанавливают реактива Фелинга..Поэтому дисахариды такого типа обычно называют невосстанавливающами дисахаридами. Такие дисахариды способны вступать лишь в те реакции моносахаридов, которые обусловлены присутствием гидроксильных групп (алкилирование, ацилирование). Пример невосстанавливающего дисахарида — сахароза, состоящая из глюкозы и фруктозы.
Второй тип дисахаридов — это дисахариды гликозидно-гликозного типа, или восстанавливающие дисахариды. К этому типу относятся важнейшие природные продукты — целлобиоза, мальтоза, лактоза. Первые два состоят из молекул глюкозы и отличаются друг от друга лишь тем, что в молекуле целлобиозы имеется связь β-гликозидного типа, а в молекуле мальтозы — связь α-гликозидного типа. В состав дисахарида лактозы входит молекула глюкозы и молекула галактозы.
 Практически дисахариды получают из природных источников.
Практически дисахариды получают из природных источников.
Сахароза (свекольный или тростниковый сахар) С12Н22О11 представляет собой дисахарид, образованный из остатков a-глюкозы и b-фруктозы (в форме полуацеталей), связанных друг с другом.
Сахароза не восстанавливает оксид серебра и гидроксид меди (II). В кислой среде сахароза гидролизуется — разлагается водой на глюкозу и фруктозу. Вот самый простой пример: сладкий чай кажется ещё более сладким, если положить в него ломтик лимона, хотя, конечно, и кислым одновременно. Это происходит благодаря присутствию лимонной кислоты, которая ускоряет распад сахарозы на глюкозу и фруктозу.
При внесении сахарозы в раствор медного купороса в присутствии щёлочи образуется ярко-синий сахарат меди — вещество, в котором атомы металла связаны с гидроксильными группами углевода.

Сахар при взаимодействии с серной кислотой легко обуг-ливается. Образующаяся чёрная пена — результат выделения угле-кислого газа.
Глюкоза, входящая в состав молекулы сахарозы имеет правостороннее вращение, а фруктоза- левостороннее, но по величине угол вращения фруктозы больше, чем угол вращения глюкозы. Переход от правостороннего вращения в левостороннее носит название инверсии сахарозы.
Промышленный способ получения сахарозы:
сахарную свеклу измельчают и извлекают из неё сахарозу горячей водой в специальных аппаратах – диффузорах. Полученный раствор обрабатывают известью для осаждения примесей, а пропусканием через раствор углекислого газа осаждают в нём гидроксид кальция. Раствор упаривают в вакуумах – аппаратах, получая рафинированный (очищенный) сахар. В зависимости от условий кристаллизации он выделяется в виде мелких кристаллов или больших «сахарных» голов, который затем раскалывают.
КАРАМЕЛЬ
Когда сахар нагревают выше температуры плавления (до 190 °С), он частично разлагается. При этом выделяется вода и образуется карамель. Это аморфная жёлто-бурая вязкая масса, застывающая при охлаждении. В процессе карамелизации часть молекул сахарозы распадается на глюкозу и фруктозу, которые в дальнейшем разлагаются:

Другая часть молекул вступает в реакции конденсации с образованием окрашенных продуктов (например, карамелена С36Н50О25 ярко-коричневого цвета). Иногда эти вещества добавляют в некоторые сорта сахара.
۩ Интересно знать
КТО САМЫЙ СЛАДКИЙ...
Из сладких веществ, несомненно, самое известное — обыкновенный пищевой сахар (сахароза). В наши дни две трети его мирового производства (более 60 млн. тонн) — это тростниковый сахар, тогда как на долю продукта из сахарной свёклы приходится примерно 35 млн. тонн. Рафинированная (99,9 %-ная) сахароза — одно из самых многотоннажных чистых органических соединений, выпускаемых промышленностью. А головой урожай сахарного тростника — около 1 млрд. тонн (!) — значительно превышает объём заготовок любой другой сельскохозяйственной культуры.
Сахарозу используют как стандарт при сравнении различных сладких веществ, которых известно великое множество. Обычно поступают так: готовят сладкий раствор известной концентрации, а затем разбавляют его водой до тех пор, пока не перестанет чувствоваться сладковатый привкус. Одного человека для таких испытаний недостаточно — ведь вкусовая чувствительность у разных людей неодинакова, поэтому определяют усреднённые данные, обобщая показатели членов специальной комиссии экспертов. Опытный дегустатор чувствует присутствие сахарозы в воде при очень малой концентрации — около 10 ммоль/л, или примерно 0,35 г/л. Интересно, что такие сластёны, как пчёлы, в тысячи раз менее чувствительны к сахару, чем человек: они не считают сладким даже раствор, в литре которого 20 г сахара (т. е. двухпроцентный). Этот странный на первый взгляд факт, становится понятным, если учесть, что в цветочном нектаре сахаров куда больше — от 40 до 70 %. И пчела просто не отвлекается на малопитательные продукты. Фруктоза — самый сладкий из природных сахаров, она в 1,7 раза слаще сахарозы, а вот глюкоза, как оказалось, вопреки распространённому мнению, в 1,3 раза менее сладкая, чем обычный сахар. Если же химическим путём заменить в молекуле сахарозы три гидроксильные группы на атомы хлора, получится вещество, которое слаще сахарозы в 2000 раз! В диетическом питании широкое распространение получили сорбит НОСН2(СНОН)4СН2ОН (от лат. Sorbus aucuparia — «рябина») и ксилит НОСН2(СНОН)3СН2ОН (от греч. «ксилон» — «дерево»). Восстановление глюкозы в сорбит осуществляется в промышленных масштабах при синтезе витамина С. Сладость сорбита в «сахарозных единицах» равна 0,5, тогда как у ксилита она в 4 раза выше. Ощущение сладкого вкуса от этих веществ сохраняется дольше, чем от сахарозы, одновременно они немного «холодят» язык. С химической точки зрения это, собственно, и не сахара вовсе, а многоатомные спирты вроде глицерина. Вот почему для усвоения сорбита и ксилита не требуется инсулин и их могут употреблять больные сахарным диабетом, организм которых не способен усваивать глюкозу. Применяют их в качестве подсластителей пиши и желающие похудеть: эти вещества малокалорийны.
Лактоза:
- молочный сахар, яаляется восстанавливающим, получают из молока: в коровьем молоке содержится 4-5,5% лактозы, в женском- 5,5-8,4%!. Не тсыревает, т.к. отсутствует гигроскопичность. Это свойство имеет большое значение: если нужно приготовить с сахаром какой-либо порошок, содержащий легко гидролизующее лекарство, то берут молочный сахар, иначе легко гидролизующее лекарственное средство быстро разложится.
При гидролизе 1 молекула лактозы распадается на молекулу α-глюкозы и молекулу β-галактозы.
СН2ОН

Лактоза восстанавливается до лактобионовой кислоты.
Мальтоза:
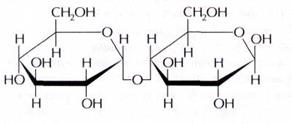
- солодоый сахар, яаляется восстанавливающим, получают из крахмала под действием солода
(солод - от лат. maltum). В живых организмах образуется благодаря пищеварительным ферментам.
При гидролизе 1 молекула лактозы распадается на 2 молекулы α-глюкозы.
Мальтоза восстанавливается до мальтобионовой кислоты.
۩ Интересно знать
КАК СОЗРЕВАЮТ ПЛОДЫ
Хорошо известно, что неспелые яблоки, груши, сливы и другие плоды жёсткие и кислые на вкус. Созревая, они постепенно становятся мягче и слаще. Отчего же это происходит?
Кислый вкус плода объясняется тем, что в его состав входят органические кислоты — яблочная, винная и лимонная. По мере созревания концентрация этих веществ понижается: они расходуются в процессе дыхания растения, окисляясь до углекислого газа и выделяя энергию, необходимую для жизнедеятельности плода. Фрукты становятся слаще и за счёт того, что в них увеличивается содержание глюкозы, образующейся при распаде (гидролизе) крахмала.
В клетках плодов много пектиновых веществ — высокомолекулярных соединений, построенных из остатков галактуроновой кислоты (производного галактозы) или её эфиров.
 По мере созревания (а также при хранении) под действием ферментов связи между отдельными молекулами галактуроновой кислоты разрываются, пектиновые вещества переходят в водорастворимую форму — и плод становится более рыхлым и мягким. Сходные процессы протекают и при варке овощей и фруктов.
По мере созревания (а также при хранении) под действием ферментов связи между отдельными молекулами галактуроновой кислоты разрываются, пектиновые вещества переходят в водорастворимую форму — и плод становится более рыхлым и мягким. Сходные процессы протекают и при варке овощей и фруктов.
Пектиновые вещества легко образуют студенистые растворы (гели), особенно при нагревании в присутствии углеводов, например, когда варят варенье, готовят джем и мармелад. При этом пектиновые вещества из фруктов переходят в раствор, который постепенно загустевает. В получившемся геле молекулы пектина образуют пространственную трёхмерную сетку. Её пустоты заполняет вода с растворёнными в ней веществами (сахарами, минеральными солями). В кондитерской промышленности для производства джемов используют пектины, специально выделенные из лимонных корок или яблок.
У спелого плода и окраска ярче, чем у незрелого. Это связано с тем, что в процессе созревания активность некоторых ферментов, ответственных за синтез красителей (каротинов, антоцианов), повышается.

ПОЛИСАХАРИДЫ
- сложные углеводы, которые при гидролизе распадаются на большое количество составляющих и х моносахаридов, связанных гликозидными связями:

Общая формула: (С6Н10О5 ) n
1. ГОМОПОЛИСАХАРИДЫ:
Крахмал - представляет собой безвкусный, белый порошок не растворимый в холодной воде. В горячей он набухает, образуя вязкий коллоидный раствор — крахмальный клейстер.
Крахмал – это полимер, мономером которого является глюкоза:

Крахмал широко распространен в природе. Он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен. В промышленности крахмал получают главным образом из клубней картофеля. Крахмал образуется в растениях из глюкозы. Это как бы энергетический резерв растений, который легко можно перевести обратно в глюкозу. Он накапливается в семенах зерновых культур и клубнях картофеля в виде крупинок размером 2— 180 мкм.
По составу это вещество неоднородно - состоит из 2-х фракций:
1) на 20% состоит из амилозы (соединённых в длинную цепь 1000—6000 остатков a-глюкозы). Амилоза не образует клейстер, с йодом даёт слабое фиолетовое окрашивание; является линейным полисахаридом. Внутри спиралевидной молекулы амилозы остаётся свободное пространство, канал диаметром 5 мкм. В этом канале могут располагаться подходящие по размеру молекулы, образуя компдексы особого типа, так называемые соединения включения (например, йод). Таким соединением включения является и синий комплекс амилозы с йодом.
2) на 80% — из амилопектина (разветвлённого полимера, содержащего до 6000 остатков a-глюкозы). Молекула амилопектина имеет шарообразную форму.
При действии ферментов или нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу. При этом сначала образуется растворимый крахмал, затем менее сложные вещества – декстрины. Конечным продуктом гидролиза является глюкоза. Гидролиз крахмала - его важное химическое свойство.


Продукты гидролиза крахмала — циклодекстрины.
Крахмал не дает реакции " серебряного зеркала ", однако ее дают продукты его гидролиза.
Подвергая крахмал гидролизу кислотами, получают глюкозу в виде чистого кристаллического препарата или в виде окрашенного некристаллизующегося сиропа. Наибольшее значение крахмал имеет в качестве пищевого продукта, являясь главным источником углеводов в нашем рационе в виде хлеба, картофеля, круп. Кроме того, чистый крахмал применяют в пищевой промышленности для производства кондитерских и кулинарных изделий, колбас. Значительные количества крахмала употребляюься для проклеивания тканей, склеивания бумаги и картона, производства канцелярского декстринового клея. В химических лабораториях крахмал служит индикатором в йодлметрическом методе объёмного количественного анализа. Для этих целей лучше применять очищенную амилозу, её растворы не загустевают, а даваемая с йодом окраска более интенсивна.
1.2 Полимер, сходный по строению с крахмалом, но с ещё более разветвлённой структурой - гликоген. Он содержится в животных организмах, в частности в печени человека его около 10%. Гликоген хорошо растворим в горячей воде и не образует клейстер. При недостатке питания организм начинает использовать гликоген, расщепляя его до глюкозы. Гликоген по своему строению сходен с амилопектином. В животном мире роль «запасного углевода» играет гликоген, откладывающийся в основном в печени. При недостатке пищи, поступающей извне, животные мобилизуют свои запасы гликогена. Это происходит под действием особых ферментов – амилаз, гидролизующих крахмал и гликоген.
474
1.3 целлюлоза:
Макромолекулы целлюлозы, или клетчатки (от лат. cellula — «клетка»), состоят из 2000—3000 остатков b-глюкозы, связанных друг с другом в волокна слабыми межмолекулярными взаимодействиями (водородными связями).
Целлюлоза — основной компонент стенок растительных клеток. Она содержится в древесине, в оболочках некоторых плодов (например, семечек подсолнечника). В чистом виде целлюлоза представляет собой белый порошок, не растворимый в воде и не образующий клейстер. Практически чистую целлюлозу представляют собой хлопковая вата и тополиный пух.
Главная причина отличия целлюлозы от крахмала: целлюлоза- типичный представитель линейных полимеров, гиганская молекула которых имеет форму нити; крахмал – столь же типичный представитель глобулярных полимеров с молекулой, имеющей форму объёмной трёхмерной частицы.
Целлюлоза труднее, чем крахмал, подвержена гидролизу. Его проводят в кислотной среде, при этом сначала образуется дисахарид целлобиоза, а затем глюкоза:

На основе очищенной целлюлозы изготавливают прозрачную плёнку — целлофан (в отличие от полиэтиленовой, она не кажется жирной на ощупь и при складывании шуршит), а также искусственное волокно — вискозу (от лат. viscosus — «вязкий»).
Целлюлоза нерастворима в воде и в большинстве других органических и неорганических растворителях. Неспособность целлюлозы растворяться в воде- столь хорошо известное из житейсткой практики свойство, что оно не привлекает особого внимания. Междк тем в сущности нерастворимость в оде вещества, содержащего по три гидроксильные группы на каждые 6 атомов углерода, - свойство неожиданное. Обычно полигидроксильные соединения, наоборот, хорошо растворяются в воде. Нарушение этого правила у целлюлозы связано с тем, что её волокна представляют собой как бы «снопы» из расположенных параллельно нитевидных молекул, сязанных множеством водородных связей за счёт взаимодейсвия гидроксильных групп. Внутрь подобного «снопа» растворитель проникнуть не не может, а следовательно, не происходит и отрыва молекул целлюлозы друг от друга, т.е. не происходит растворения.
Растворяет целлюлозу реактив Швейцера – тёмно-синий раствор гидроксида меди в концентрированном водном аммиаке. Сильные кислоты и концентрированный раствор хлорида цинка также растворяют целлюлозу, но при этом наблюдается сильная деструкция – распад, сопровождающийся уменьшением молекулярной массы.
 2020-04-12
2020-04-12 181
181








