ППКРС по профессии 43.01.09 «Повар, кондитер»
Дисциплина «Химия»
1.Глюкоза – представитель моносахаридов, состав молекул, свойства, применение.
2. Химические источники тока. Гальванические элементы и аккумуляторы, принципы их работы. Гальванические элементы, применяемые в жизни.
3. Задача. Закончить уравнения, расставить коэффициенты. Написать полное и сокращенное ионные уравнения: MgSO4 + NaOH = …………..+………………
Преподаватель _____________________ Каева Е.В.
Эталон решения расчетных задач
Задача №1.
| Дано: m(NaСl р-ра) =180г w%(NaCl)=8 % m(NaCl) = 20 г | Решение: mр-ра = 180г+20г=200г. – 1 балл m1NaCl = 180*0,08=14,4 г. – 1 балл m2NaCl = 14,4 + 20 = 34,4 г w% = w%(NaCl в р-ре)= Ответ: w%(NaCl в получ. р-ре) = 17,2% |
| Найти: w%(NaCl в получ. р-ре)-? |
Задача №2.
| Дано: m(KCl)=5 г m(H2O)=45 г | Решение: m(раствора)=m(KCl)+m(H2O)=45г+5г=50г w%(KCl) = Ответ: w%(KCl)=10% |
| Найти:w%(KCl) -? |
Задача №3.
| Дано: D(СnH2n по возд.) = 2,41 | Решение: Найдем молярную массу алкена: М = D(возд) х М (возд) = 2,41 * 29 г/моль = 70 г/моль, где D(возд) - плотность паров алкена по воздуху; 29 г/моль - молярная масса воздуха. Общая формула алкенов: СnH2n.М(алкена) = 12n + 1*2n (12 - атомная масса углерода, 1 - атомная масса водорода). Отсюда найдем n: Ответ: Формула алкена - С5Н10 (пентен) |
| Найти: молек. формула-? |
Задача №4.
| Дано: w%(солей)-3,5% m (воды морской)= 10 кг =1000г | Решение: m(соли) = w(солей)* m(воды) m(соли) = 0,035*1000 г = 350 г Ответ: m (соли)=350 г. |
| Найти: m (соли) -? |
Задача №5.
| Дано: V (C2H6) = 4, 48 л m(C2H5NO2) =12 г | Решение: 4,48 л x г C2H6+HNO3=C2H5NO2+H2O 22,4 л/моль 75 г/моль M(C2H5NO2) = 12*2+1*5+14+16*2= 75 (г/моль) Vm(C2H6)= 22,4 л/моль Х = w (C2H5NO2) =
Ответ: w (C2H5NO2) = 80 %. |
| Найти: w (C2H5NO2) -? |
Задача №6.
| Дано: n(H2SO4) =0,2 моль | Решение: M(H2SO4) = 98 г/моль m (H2SO4) = M(H2SO4) *n(H2SO4) = 98 г/моль * 0,2 моль = 19,6 г. Ответ m (H2SO4) =19,6 г. |
| Найти: m (H2SO4) -? |
Задача № 7.
| Дано: n (НCl) =7 моль | Решение: M(НCl)=36,5 г/моль m (НCl) = M(НCl) *n(НCl) = 36,5г/моль * 0,7моль = 25,55г. Ответ: m (НCl) = 25,55г. |
| Найти: m (НCl) -? |
Задача №8.
| Дано: m(Са(ОН)2) = 37 г | Решение: m-х г----------------37г х = (37*56)/74 = 28 (г). Ответm (СаО) = 28 г. |
| Найти: m (СаО) -? |
Задача №9.
| Дано: w% 1(р-ра)=10% w%2(р-ра) = 30% w%(смеси) = 16% m(смеси) = 200г | Решение:
0,1х + 0,3(200-х) = 0,16 · 200 Ответ: 140 г, 60 г. | ||||||||||||
| Найти: m1 (р-ра) -?; m2 (р-ра) -? |
Задача №10.
| Дано: m(NaOH) =100г w%(NaOH)=5 % m(H2O) = 100 г | Решение: mр-ра = 100г+100г=200г. mNaOH = 100*0,05=5г. w%(NaOH в р-ре)= Ответ: w%(NaOH в р-ре) = 2,5%
|
| Найти: w%(NaOH в р-ре)-? |
Задача №11.
| Дано: m(р-ра) =500г w%(марганцовки)=15 % | Решение: w% = m(в-ва) = m (р-ра)*w m (марганцовки) = 500 г*0,15= 75 г
Ответ: 75 г марганцовки
|
| Найти:m (марганцовки)-? |
Задача №12.
| Дано: m(BaSO4) = 100 г; M (BaSO4) = 233 г/моль | Решение: Запишем уравнение реакции и условие задачи в формульном виде: BaO + H2SO4 = BaSO4 + H2O В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO4 требуются: n(BaO) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100г: 233 г/моль = 0,43 моль Ответ: Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты. |
| Найти:n(BaO) -?n(H2SO4)-? |
Задача № 13.
| Дано: m(углеводорода) =8,6г m(СО2) =26,4 г m(H2O) = 12,6 г D (по возд.)= 2,966 | Решение: Пусть состав органического вещества – СxHy 2. Записываем в общем виде уравнение реакции горения органического вещества:
3. Вычисляем молярную массу органического вещества: М (СxHy) = D (по возд.)* М(возд.) = 2,966*29г/моль=86 г/моль
6. Составляем простейшую формулу углеводорода: С6Н14 7. Проведем проверку ответа. Для этого вычислим молярную массу простейшего углеводорода: М (С6Н14) = 12*6 +14 = 86г/моль. Это значение совпадает с М (СхНy). Ответ: С6Н14. |
| Найти: молекулярную формулу вещества |
Задача №14.
| Дано: m(СаСO3) = 80 г; w%примесей =20% | Решение: Вычислим массу чистого CaCO3: w%чист(CaCO3) = 100% - w%(примесей) = 100% - 20% = 80% m(CaCO3чист.) = m(тех.прод) ∙ w% (осн.комп) \100% = 80 г∙ 80%\100% = 64 г Рассчитаем объем углекислого газа: 64 г х л CaCO3 ------> CO2↑ + CaO 100 г 22,4 л
64 г --- х л 100 г --- 22,4 л х = 64 г ∙ 22,4 л\100 г = 14,3 л Ответ: V(СО2) = 14,3 л |
| Найти:V (CO2)-? |
Задача №15.
Решение:
Расставьте коэффициенты с помощью метода электронного баланса в уравнении реакции и подсчитайте массу окислителя и восстановителя.
 4H+Cl- + Mn+4O22- Cl20 + Mn2+Cl2- + 2H2+O2- 4H+Cl- + Mn+4O22- Cl20 + Mn2+Cl2- + 2H2+O2-
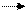  1 2Cl- - 2ē Cl20 окисляется, восстановитель 1 2Cl- - 2ē Cl20 окисляется, восстановитель
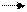 1 Mn+4 + 2ē Mn2+ восстанавливается, окислитель 1 Mn+4 + 2ē Mn2+ восстанавливается, окислитель
 2Cl- + Mn+4 Cl20 + Mn2+
MMnO2 = 55+162=87 (окислитель)
M(HCl) = 1+35,5 = 36,5 (восстановитель). Т.к. НСl 4 моль, то масса его 36,5*4 = 146 2Cl- + Mn+4 Cl20 + Mn2+
MMnO2 = 55+162=87 (окислитель)
M(HCl) = 1+35,5 = 36,5 (восстановитель). Т.к. НСl 4 моль, то масса его 36,5*4 = 146
|
Задача №16.
| Дано: m(S) = 1 г; Нобр.(SO2)=297 кДж | Решение: Запишем уравнение реакции: S+O2=SO2 Определим количество моль серы n(S) =1г/32 г/моль=0,03 моль. Тогда по уравнению количество SO2 также равно 0,03 моль. Так как теплота образования 1 моль SO2 равна 287 кДж, то при образовании 0,03 моль SO2 выделится: 1 моль -------287 кДж 0,03 моль ----х кДж х=0,03*287 = 8,61 (кДж) Ответ: выделится 8,61 кДж тепла. |
| Найти:Q -? |
Задача №17.
| Дано: V(газа) = 1 л; m(газа) =1,25 г | Решение: n(газа) = M(газа) = Ответ: M(газа) = 28 г/моль |
| Найти: Относительную молекулярную массу газа (М) |
Задача №18.
| Дано: Dпо водор.(в-ва) = 22 w%(Н) =9,09 % w%(С) =54,55 % w%(О) =36,36 % | Решение: Допустим, что масса вещества 100 грамм, тогда: m(С)=54,55 г; m(Н)=9,09 г; m(О)=36,36 г Находим
Получаем соотношения
С2H4O - уксусный альдегид M(в-ва)=2*DH2=2*22=44 г/моль M(C2H4O)=44 г/моль Ответ: C2H4O |
| Найти: Молекул.формула -? |
Задача №19.
| Дано: m(железной руды) =2 г w%(Fe2O3) = 94% | Решение: Железная руда содержит чистого Fe2O3: 0,94*2г = 1,88 г. Молярная масса Fe2O3 равна 56*2+16*3 =112+48=160г/моль; Молярная масса Fe в Fe2O3 равна 112 г\моль. Содержание железа в Fe2O3 составляет 112/160 = 0,7; Масса получаемого железа равна 0,7*1,88=1,316г. Ответ::m(Fe) = 1,316 г |
| Найти: m(Fe)-? |
Задача №20.
| Дано: m(керосина) =300 г w%(С) = 86% w%(Н) = 14% | Решение: Массы углерода и водорода в керосине: Ответ: m(CO2) = 946 г; |
| Найти: m(Н2О)-? m(СО2)-? |
Задача № 21.
| Дано: pH = 4 | Решение: pH = lg [H+] [H+] = 10-4, а т.к. [H+] * [OH-] = 10-14, то [OH-] = 10-10 Ответ: [H+] = 10-4; [OH-] = 10-10 |
| Найти: [H+] –? [OH-] -? |
Задача №22.
| Дано: m(2-метилгексана) =2,45 г практ.выход(h) – 75% | Решение:
СН3 СН3 Из 2,45 г -------х л. Из 100 г --------22,4 л; х =2,45г*22,4л / 100г = 0,55 л Vпр.(Н2)=Vтеор.(Н2)* h = 0,55л* 0,75 = 0,41 л Ответ: 0,41 л водорода
|
| Найти: V(Н2)-? |
Задача №23.
| Дано: V(N2)=6 л | Решение: n(газа) = M(газа) = Ответ: m(N2) = 7,56 г |
| Найти: m(N2) =? |
Задача № 24.
| Дано: m(Ca) =1,6г m(Zn)=2,61г Э(Са) = 20 г/моль | Решение: Т.к. по условию задачи 1,6 г Са и 2,61 г Zn вытесняют из кислоты одинаковые количества водорода, то согласно закону эквивалентов: 1,6 г Са эквивалентны 2,61 г Zn 20 г/моль Са эквивалентны х г/моль Zn; Тогда х = 20*2,61/1,6 = 32,6 (г/моль) Ответ: Э(Zn) = 32,6 г/моль |
| Найти: Э(Zn) =? |
Задача №25
| Дано: m(SiO2)=40г | Решение: Хг 40г 2NaOH+SiO2 = Na2SiO3+H2O n=2моль;n=1 моль М=80г/моль;M=60 г/моль Составляем пропорцию: Хг ---------------40 г 80г/моль -------60 г/моль, откуда х=80*40/60=53,3 г. Ответ: m(NaOH)= 53,3 г. |
| Найти: m(NaOH)=? |
Задача № 26
| Дано: g=3 t2 =60°C t1=30°C | Решение: По правилу Вант-Гоффа: Ответ: скорость реакции увеличится в 27 раз.
|
Найти: 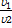 -? -?
|
Задача №27
| Дано: g=2,5 t2 =50°C t1=30°C | Решение: По правилу Вант-Гоффа: Ответ: скорость реакции уменьшится в 6,25 раз.
|
Найти: 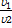 -? -?
|
Задача №28
| Решение: MgSO4 + 2NaOH = Mg(ОН)2+Na2SO4 –молекулярное уравнение Mg+2 +SO42- + 2Na+ +2OH- = Mg(ОН)2+2Na++ SO42- - полное ионное уравнение Mg+2 +2OH- = Mg(ОН)2 - сокращенное ионное уравнение |
 2020-04-12
2020-04-12 103
103
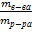 *100%
*100%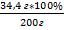 = 17,2 % - 1 балл
= 17,2 % - 1 балл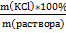 =
= 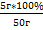 =10%
=10%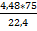 = 15 (г) – теоретический выход
= 15 (г) – теоретический выход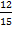 = 0,8 или 80 % - практический выход.
= 0,8 или 80 % - практический выход.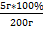 = 2,5 %
= 2,5 %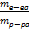 *100%; w =
*100%; w = 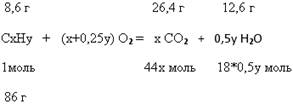

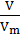 =
= 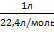 = 0,0446 моль
= 0,0446 моль =
= 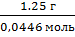 = 28 г/моль
= 28 г/моль - химическое количество
- химическое количество 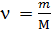
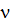 (Н):
(Н):  (C) = m/M = 258 г/12 г/моль = 21,5 моль. Столько же будет СО2.
(C) = m/M = 258 г/12 г/моль = 21,5 моль. Столько же будет СО2.
 СН3 – СН – СН2 – СН2 – СН2 – СН3àCН3 – СН – СН = СН – СН2 – СН3 + Н2
СН3 – СН – СН2 – СН2 – СН2 – СН3àCН3 – СН – СН = СН – СН2 – СН3 + Н2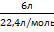 = 0,27 моль
= 0,27 моль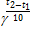 =
= 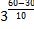 =
= 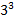 = 27
= 27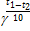 =
= 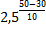 =
= 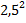 = 6,25
= 6,25






