Количество кислорода, эквивалентное расходу окислителя на окисление загрязнений, называется окисляемостью. В зависимости от применяемого окислителя различают перманганатную, бихроматную, и др. окисляемость. Результаты, полученные разными методами, могут быть различными для одной и той же пробы вследствие неодинаковой полноты окисления, которая зависит от свойств окислителя, его концентрации, температуры, рН и др. факторов.
Для определения перманганатной окисляемости питьевых и поверхностных вод в пределах до 100 мг кислорода используют метод Кубеля. Для общей окисляемости сточных вод применяется метод определения окисляемости бихроматом.
Определение методом Кубеля.
Метод основан на окислении веществ, присутствующих в пробе воды, 0,01Н раствором перманганата калия в сернокислой среде при кипячении.
Без разбавления можно определить окисляемость до 10 мг кислорода в 1 л. Наивысшее допустимое разбавление проб - десятикратное. Это означает, что метод можно использовать только для проб, окисляемость которых ниже 100 мг кислорода в 1 л.
Мешающее влияние.
При определении окисляемости, дающей приблизительное представление о содержании в пробе окисляемых органических веществ, необходимо устранить мешающее влияние неорганических соединений, которые могут быть окислены при определении. К таким соединениям относятся хлориды, сульфиды, нитриты, железо (II).
Железо (II), сероводород, сульфиды и нитриты следует определить отдельно, и результат, пересчитанный на окисляемость (мг О в 1 л), вычесть из найденной величины окисляемости проб. 1 мг Н2S соответствует 0,47 мг О, 1 мг  соответствует 0, 35 мг О, 1 мг
соответствует 0, 35 мг О, 1 мг  соответствует 0,14 мг О.
соответствует 0,14 мг О.
Реактивы, посуда, аппаратура.
Серная кислота, разбавленный раствор.
Прибавляют один объем 96%-ной серной кислоты ч.д.а. при перемешивании к двум объемам дистиллированной воды. К полученному раствору при температуре около 40°С добавляют 0,01 Н раствор перманганата до слабо розовой окраски.
Щавелевая кислота 0,2 Н основной раствор.
Растворяют 6,3020 г (СООН)2*2H2Oч.д.а. в разбавленной (1:15) серной кислоте и серной кислотой доводят объем при температуре 20°С до 1 л. Раствор можно сохранять в склянке из темного стекла до полугода.
Щавелевая кислота 0,01 Н раствор.
Доводят 100 мл 0,1 Н основного раствора щавелевой кислоты до 1 л разбавленной (1:15) серной кислотой. Титрованный раствор можно также приготовить растворением навески 0,6303 г  *2
*2 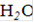 ч.д.а. в разбавленной (1:15) серной кислоте и добавлением кислотой до 1 л.
ч.д.а. в разбавленной (1:15) серной кислоте и добавлением кислотой до 1 л.
Перманганат калия, приблизительно 0.1 H основной раствор.
Растворяют 3,2 г КMnO4 в 1 л дистиллированной воды. Сохраняют в темной склянке. Изредка перемешивают. Раствор можно применять не раньше, чем через две-три недели.
Перманганат калия 0,01 Н раствор.
В мерную колбу емкостью 1 л отбирают 110 мл отстоявшегося основного раствора перманганата калия и доводят объем до метки дистиллированной водой. После нескольких дней отстаивания концентрацию раствора корректируют так, чтобы поправка к титру была равна 1,00. Для этого в колбу для определения окисляемости отбирают 100 мл дистиллированной воды, которая не должна содержать органических веществ (можно использовать оттитрованную пробу после определения окисляемости), прибавляют 10 мл 0,01 Н раствора щавелевой кислоты и 5 мл разбавленной серной кислоты (кислоту не прибавляют, когда используют оттитрованную пробу после определения окисляемости). Смесь нагревают до кипения и титруют в горячем виде раствором перманганата калия до слабо-розовой окраски. В зависимости от результата титрования концентрацию раствора перманганата корректируют затем так, что поправка была равной 1,00. Если поправка отличается от 1,00 больше, чем на 0,05 нужно соответственно повысить концентрацию или разбавить раствор. Титр раствора перманганата следует контролировать по крайней мере один раз в неделю.
Вода для разбавления.
Для разбавления проб применяют дистиллированную воду или бидистиллированную воду, не содержащую окисляемых веществ.
1. В колбу для кипячения помещают несколько стеклянных шариков и 100 мл пробы водопроводной воды (после двухчасового отстаивания) или меньший ее объем, доведенный до 100 мл дистиллированной водой для разбавления. Приливают 5 мл разбавленной серной кислоты и 20 мл 0, 01 Н раствора перманганата калия. Смесь нагревают так, чтобы она закипела, и кипятят точно 10 мин. К горячему раствору прибавляют 20 мл 0,01 Н щавелевой кислоты.
2. Обесцвеченную смесь титруют горячей (лучше всего при 80-90°С) 0,01 Н раствором перманганат калия до розового окрашивания. Температура смеси при титровании не должна падать ниже 80°С. Израсходованный объем перманганата отсчитывают с точностью до 0,05 мл.
3. Для холостой пробы отбирают 100 мл разбавленной воды и обрабатывают ее так же, как и анализируемую пробу.
Результаты титрования:x = 4,1; V = 3,6; V2 = 2,5; V3 = 3,6; Vcp = 3,7; Vx=1,2
4. Окисляемость по Кубелю (х) в мг O/л вычисляют по формуле:
, мгО/л =(а-в)*0,01*8*1000/V
где: а - объем 0,01 Н раствора перманганата, израсходованного на титрование пробы, в мл;
в - объем 0,01 Н р-ра перманганата, израсходованного на титрование холостой пробы, в мл;- объем пробы, взятой для определения, в мл;, мгО/л =(3,7-1,2)*0,01*8* 1000/100=2 мгО/л
Вывод: в результате проведенного нами исследования мы определили, что перманганатная окисляемость исследуемой пробы воды равна 2 мгО/л.
Заключение
В целом из всего комплекса проведенных нами исследований можно сделать вывод, что вода, подаваемая из скважины г. Н. Новгорода, автозаводского района, посёлок Малышево удовлетворяет большинству требований. Допустимую концентрацию превышают: цветность, содержание железа и содержание аммонийного азота.
| Определяемые компоненты | Результат | Допустимая концентрация по ГОСТу |
| Запах | 0 | 2 |
| Вкус | - | 2 |
| Привкус | - | 2 |
| Цветность | 41,65° | 20° |
| Сухой остаток | 0,418 мг/л | 1000 мг/л |
| pH | 6 | 6-9 |
| Окисляемость | 2мгО/л | 5мгО/л |
| Содержание нитратов | 37,2 мг/л | 45 мг/л |
| Содержание фторидов | 0,22 мг/л | 1,5 мг/л |
| Содержание хлоридов | 8,875 мг/л | 350 мг/л |
| Электропроводность | 455 мкСМ/см | 5,48мСМ/см |
| Содержание железа | 3 мг/л | 0,3 мг/л |
| Общая жёсткость | 3,28 мэкв/л | 7мэкв/л |
| Временная жёсткость | 37,08мг/л | 1000 мг/л |
| Содержание аммонийного азота | 1,37 мг/л | 1мг/л |
| Общая мин. воды | 0,59673 г/л | 1 г/л- столовая |
Свыше 10г/л- лечебная, 1-10 г/л- лечебно-столовая, до 1 г/л- столовая.
Литература
1. Челышева С.Ф. Методы химического анализа загрязнений природной среды. Учебное пособие. Часть 1. / С. Ф. Челышева. - Н. Новгород: ННГАСУ, - 1999 г. - 112 с.
2. Челышева С. Ф. Методы химического анализа окружающей среды. Анализ водных объектов. Методические указания. Часть 1. / С. Ф. Челышева. - Н. Новгород: ННГАСУ, 2004. - 16 с.
3. Челышева С.Ф. Химический анализ природных и сточных вод. Химические методы количественного анализа. Методическое указание. Часть 1. / С. Ф. Челышева. - Н. Новгород: ННГАСУ, - 1993. - 56 с.
4. Челышева С. Ф. Химический анализ природных и сточных вод. Потенциометрия. Потенциометрическое титрование. Методическое указание. Часть 2. / С. Ф. Челышева. - Н. Новгород: ННГАСА, 1994. - 34 с.
5. Челышева С. Ф. Химический анализ природных и сточных вод. Оптические методы анализа. Методическое указание. Часть 4. / С. Ф. Челышева. - Н. Новгород: ННГАСУ, 1995. - 38 с.
6. Челышева С. Ф. Методы определения и способы устранения жесткости воды. Методическое указание. / С. Ф. Челышева. - Н. Новгород: ННГАСУ, 1996. - 22 с.
 2020-04-20
2020-04-20 792
792







