2-метил,3-хлорбутен-1 Выделяем основу (корень): бутен. Это производное от названия предельного углеводорода бутан, в формуле которого четыре атома углерода. Рисуем цепочку из четырех атомов углерода, соединенных одинарной связью: С-С-С-С. В слове бутен был суффикс ен, это значит есть двойная связь. Возле суффикса стоит цифра 1, значит связь находится между первым и вторым углеродом. Ставим ее: С=С-С-С. Около второго атома дописываем группу –СН3 (2-метил). Возле третьего атома дописываем Cl- (3-хлор). Посчитаем, сколько свободных валентностей осталось у каждого атома углерода и дописываем соответствующее число атомов водорода около атомов углерода.
6. В реакциях между органическими веществами участвуют молекулы, образованные за счет ковалентных связей. Органические молекулы в целом достаточно устойчивы и даже инертных, в реакции участвует какая-то часть молекулы – «активный центр», самое уязвимое место. Поэтому вместо молекулярных формул при записи реакции используют структурные, которые наглядно показывают какая часть молекулы подверглась превращению.
Многообразие органических соединений, огромное разнообразие электронных структур и конфигураций у этих молекул приводит к большому числу химических превращений, которые трудно сгруппировать в определенную схему. Но большинство реакций можно отнести к одному из трех типов: замещения, присоединения, распада. Только надо помнить, что в органических реакциях вещества «неравноправны». Есть «субстрат» (Sy) - органическая молекула, большая и ленивая. А есть «реагент» (Re) - маленький и
активный. Поэтому есть расхождения в понимании некоторых терминов с неорганической химией.
Реакции замещения: Sy-X + Re-Y ↔ Sy-Y + Re-X
Реакция присоединения и отщепления: Sy + Re ↔ Sy-Re
Обратите внимание – процессы обычно обратимы и при определенных условиях будет протекать прямая или обратная реакция. Особым случаем реакции присоединения можно считать реакции полимеризации (процесс соединения большого числа маленьких молекул в одну большую) и реакцию изомеризации (исходное вещество меняет свое строение, т.е. связи рвутся и вновь образуются между атомами исходного вещества и другие соединения в процессе не участвуют).
Реагентов, которые участвуют в реакциях замещения-присоединения-отщепления не много. Это прежде всего: H2 Cl2 HCl H2O … Какие из них участвую в процессе можно определить по названию реакции: гидрирование - дегидрирование; гидратация - дегидратация; галогенирование - дегалогенирование; гидрогалогенирование - дегидрогалогенирование… Причем для всех этих типов можно выделить определенный алгоритм написания уравнений реакций.
Инертность химических связей в органических соединениях обусловливает большую роль электронной природы реагента в химических реакциях. Поэтому в органической химии в дополнение к обычной классификации вводят понятие нуклеофильных и электрофильных реагентов и свободных радикалов. Нуклеофильные реагенты – это анионы или молекулы с повышенной электронной плотностью, имеющие неподеленную пару электронов на внешнем уровне или отрицательный заряд, при образовании связи они выступают как доноры электронов. Например, нуклеофилы – ОН-, Cl-, NH3, H2O… Электрофильные реагенты – это катионы водорода и металлов или молекулы, обладающие сродством к электрону, имеют свободную орбиталь на внешнем уровне, при образовании связи они выступают как акцептор электронов. Например, H+, Me+n… Свободные радикалы – частицы, которые имеют неспаренный электрон и отличаются высокой химической активностью. Существуют самостоятельно доли секунды.
| По частным признакам: гидратация и дегидратация, гидрирование и дегидрирование, нитрование, изомеризация, окисление или восстановление, полимеризация, пиролиз… |
| По электронной природе реагента: нуклеофильные электрофильные, свободнорадикальные, протоннодонорные окисление… |
| По изменению числа частиц в ходе реакции: замещения (S), присоединения (A), отщепления (E) перегруппировки… |
| Классификация органических реакций |
| По механизмам элементарных стадий: нуклеофильное замещение SN, электрофильное замещение SE, электрофильное присоединение AE, свободнорадикальное замещение SR… |
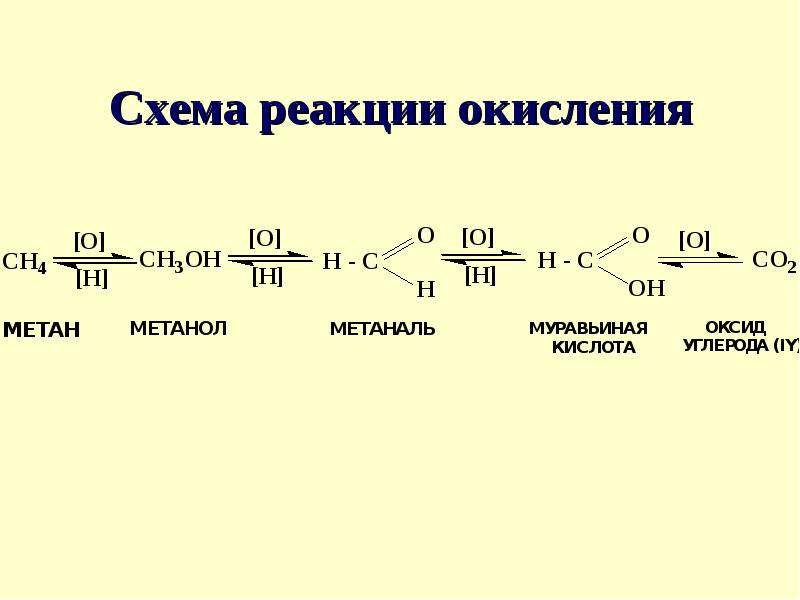
Реакции окисления и реакции восстановления в органике тоже имеют особенности. Нас интересуют что происходит с органической молекулой, окисляется она и восстанавливается, а что при этом происходит с реагентом – никому не интересно. Например, когда глюкоза взаимодействует с кислородом, происходит процесс окисления глюкозы (повышается степень окисления углерода в молекуле глюкозы) и восстановления кислорода (его степень окисления понижается). С6Н12О6 + О2 → СО2 + Н2О. Но реакцию мы называем «окисление глюкозы», а не «восстановление кислорода». При окислении органическая молекула приобретает атомы кислорода или теряет атомы водорода. При восстановлении – теряет атомы кислорода или присоединяет водород. Восстановителем в органике практически всегда является Н0, его условно обозначают [H]. А окислителем могут быть разные частицы: и О0 и марганцовка и ионы металлов. Условно окислитель обозначают [О].
В органической химии использование обобщенной концепции окисления-восстановления и понятие о степени окисления часто малопродуктивно, особенно при незначительной полярности связей между атомами. Степень окисления атома углерода в органических соединениях в классическом смысле – величина оооооочень условная и никак не связана с реальным распределением электронной плотности в молекуле. В органической молекуле у разных атомов углерода – разные степени окисления и они могут меняться тоже по-разному. Степень окисления позволяет использовать для расстановки коэффициентов в органических уравнениях метод электронного баланса. Но мы не будем рассматривать эти сложные вопросы.
В органической химии гораздо удобнее говорить не о степени окисления, а о «степени окисленности» атома углерода. Под степенью окисленности атома углерода понимают число связей этого атома с атомами кислорода. Если в процессе реакции число связей с кислородом у атома увеличивается, этот процесс называют окислением, если уменьшается – восстановлением. Увеличение связей с кислородом обычно связано с отщеплением водорода, а уменьшение числа связей с кислородом – с присоединением атомов водорода к органической молекуле.
Например:
1) Углеводороды - неокисленная форма органического соединения. Все атомы углерода имеют связи только с атомами водорода или углерода, степень окисленности углерода считают равной 0. СН3-СН3
 2) Спирт. Один из атомов углерода имеет одну связь с кислородом, его степень окисленности считают равной +1. CH3-CH2-OH
2) Спирт. Один из атомов углерода имеет одну связь с кислородом, его степень окисленности считают равной +1. CH3-CH2-OH
 3) В альдегидах и кетонах один из атомов углерода имеет две связи с кислородом, его степень окисленности считают равной +2.
3) В альдегидах и кетонах один из атомов углерода имеет две связи с кислородом, его степень окисленности считают равной +2.
4) В карбоновых кислотах один из атомов углерода имеет три связи с кислородом, его степень окисленности считают равной +3.
5) Максимально возможная степень окисленности +4 появляется в молекуле СО2, т.к. здесь углерод все возможные для него четыре связи тратит на связь с кислородом.
Для написания схем ОВР в органической химии очень удобно пользоваться «дорогой ОВР», по которой в основном и протекают эти реакции. Обычно в процессе реакции ОВ окисляется или восстанавливается только углерод функциональной группы, а углеродная цепь не подвергается изменениям. Только при образовании карбоновых кислот (т.е. на третьей стадии окисления) или при окислении непредельных соединений углеродная цепь начинает разрываться, потому что углерод карбоксильной группы должен быть первичным. Процесс окисления органических молекул протекает постепенно, образуется целый ряд промежуточных продуктов реакции. Если проводить процесс при мягких условиях, эти промежуточные продукты можно выделить. Окончательное разрушение углеродного скелета происходит только на последней стадии, при образовании углекислого газа. Если реакция протекает при жестких условиях (горение или полное окисление), то пишут сразу конечные продукты окисления (углекислый газ и воду).
Углеводород (0) ↔ спирт (+1) ↔ альдегид (+2) ↔ карбоновая кислота (+3) ↔СО2 (+4)
 2020-04-07
2020-04-07 368
368







