З курсу фізики середньої школи відомо, що властивості ідеальних газів описуються рівняннями Бройля-Маріота, Гей-Люсака, та ін., знайденими експериментально. Але можна, теоретично вивести рівняння, з якого всі зазначені вище закони будуть випливати як наслідки. Тому таке рівняння називають основним рівнянням кінетичної теорії газів.
Основним рівнянням кінетичної теорії газів називають рівняння, що встановлює зв’язок між тиском газу і його енергією. При своєму рухові молекули газу неперервно ударяється об стінки посудини. Удари чергуються один за одним дуже швидко, усереднюються і створюють постійну силу, що діє на стінки посудини. Внаслідок цього газ створює на стінки посудини тиск, який дорівнює:
 , (5)
, (5)
де f – сила, що діє на стінку, S – площа стінки.
Знайдемо цей тиск. Для цього розглянемо посудину з газом у вигляді кубу з довжиною ребра l (рис. 1) в якому хаотично рухаються молекули.

Рис. 1
В зв’язку з повною хаотичністю руху молекул можна вважати, що  всіх молекул рухаються прямолінійно між передньою і задньою стінками куба,
всіх молекул рухаються прямолінійно між передньою і задньою стінками куба,  молекул – між правою і лівою стінками і
молекул – між правою і лівою стінками і  – між верхньою і нижньою гранями. Від такого спрощення результат дії молекул не змінюється.
– між верхньою і нижньою гранями. Від такого спрощення результат дії молекул не змінюється.
При пружному ударі об стінку, маса якої нескінченно велика в порівнянні з масою молекули m, кожна молекула, що рухається зі швидкістю n, в результаті чого її імпульс зміниться на величину, рівну:
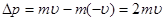 .
.
Ця зміна імпульсу молекули відбувається під дією імпульсу сили  , що діє зі сторони стінки на молекулу під час удару. За другим законом Ньютона маємо:
, що діє зі сторони стінки на молекулу під час удару. За другим законом Ньютона маємо:
 ,
,
 , (6)
, (6)
де  – тривалість удару.
– тривалість удару.
По третьому закону Ньютона сила, чисельно рівна  , буде діяти зі сторони молекули на стінку. Відскочивши від стінки, молекула полетить до протилежної стінки, і, відскочивши від неї, знову вернеться до першої стінки через деякий час Dt. Середня сила Df, що діє на стінку за весь час між двома послідовними ударами молекули, визначиться з умови, що її імпульс
, буде діяти зі сторони молекули на стінку. Відскочивши від стінки, молекула полетить до протилежної стінки, і, відскочивши від неї, знову вернеться до першої стінки через деякий час Dt. Середня сила Df, що діє на стінку за весь час між двома послідовними ударами молекули, визначиться з умови, що її імпульс  повинний чисельно дорівнювати імпульсу сили
повинний чисельно дорівнювати імпульсу сили  , що діє в продовж
, що діє в продовж  . Тоді замість рівняння (6) маємо:
. Тоді замість рівняння (6) маємо:
 (7)
(7)
Величина Dt являє собою час, за який молекула проходить відстань 2l. Отже:
 (8)
(8)
Підставляючи це значення  в формулу (7), одержимо:
в формулу (7), одержимо:
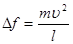 (9)
(9)
Ми знайшли середню силу удару однієї молекули. Але різні молекули рухаються з різними швидкостями  Тоді сумарна сила удару молекул об стінку буде рівна:
Тоді сумарна сила удару молекул об стінку буде рівна:
 (10)
(10)
де  – число молекул, що рухаються між двома протилежними стінками.
– число молекул, що рухаються між двома протилежними стінками.
В першій частині рівняння (10) винесемо  за дужки, помножимо і поділимо його на
за дужки, помножимо і поділимо його на  . Одержимо:
. Одержимо:
 (11)
(11)
Величина  являє собою середнє значення квадратів швидкостей молекул, а величина, рівна
являє собою середнє значення квадратів швидкостей молекул, а величина, рівна  називається середньою квадратичною швидкістю. Тоді замість (11) маємо:
називається середньою квадратичною швидкістю. Тоді замість (11) маємо:
 (12)
(12)
Як вказано вище, число молекул, що рухаються між двома протилежними стінками,  . Отже, одержуємо:
. Отже, одержуємо:
 (13)
(13)
Підставивши це значення f в формулу (5) і враховуючи, що площа грані  знаходимо:
знаходимо:
 . (14)
. (14)
Але  – об’єм кубу. Отже
– об’єм кубу. Отже  – являє собою число молекул в одиниці об’єму. Тому маємо:
– являє собою число молекул в одиниці об’єму. Тому маємо:
 . (15)
. (15)
З останнього виразу випливає, що тиск, що виконує газ на стінки посудини визначається числом молекул в одиниці об’єму  , масою молекули m і середньою квадратичною швидкістю.
, масою молекули m і середньою квадратичною швидкістю.
Формулу (10) можна записати в іншому вигляді. Помноживши і поділивши праву частину на два, одержимо:
 , (16)
, (16)
але  – представляє собою середню кінетичну енергію руху молекули. Тому маємо:
– представляє собою середню кінетичну енергію руху молекули. Тому маємо:
 . (17)
. (17)
тобто тиск газу пропорційний середній кінетичній енергії молекул одиниці об’єму.
Співвідношення (15) і еквіваленти (17) називається основним рівнянням кінетичної теорії газів згідно (17) тиск газу дорівнює 2/3 кінетичної енергії поступального руху молекул, вміщених в одиниці об’єму.
Таким чином, для обрахунків тиску газу необхідно знати середню кінетичну енергію молекул або їхню середню квадратичну швидкість. Найчастіше відома температура газу. Тому знайдемо формулу для визначення цих величин через температуру газу. Для цього помножимо ліву і праву частини рівняння (17) на об’єм одного моля Vo, одержимо:
 (10)
(10)
Але по  – кількість молекул в 1 молі. Отже
– кількість молекул в 1 молі. Отже  – число Авогадро.
– число Авогадро.
Тому формула (18) має вигляд:
 (19)
(19)
Порівнюючи вираз (19) з рівнянням стану ідеального газу  , знаходимо:
, знаходимо:
 (20)
(20)
Звідси
 (21)
(21)
Оскільки R і N – величини сталі, то і величина k рівна:
 (22)
(22)
теж буде сталою. Вона носить назву сталої Больцмана. Її значення дорівнює:
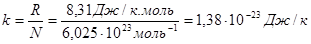
Після чого формула (21) записується так:
 (23)
(23)
Стала Больцмана k є однією з найважливіших фундаментальних фізичних сталих і має зміст універсальної газової сталої, віднесеної до однієї молекули газу.
З рівняння (23) випливає молекулярно-кінетичний зміст температури. Температура газу визначається середньою кінетичною енергією поступального руху молекул.
Вираз (23) можна записати так:
 (24)
(24)
Звідси можна визначити середню квадратичну швидкість молекул:
 (25)
(25)
 (26)
(26)
Підставивши в формулу (17) значення середньої кінетичної енергії за формулою (23):
 (27)
(27)
Рівняння (27) дозволяє обчислити кількість молекул, наприклад, в електровакуумних приладах.
 2020-04-20
2020-04-20 139
139








