Конформації хімічної частинки і їх структурні параметри
Теоретична частина.
Існують такі функції, що описують стан електрона, як атомна орбіталь, молекулярна орбіталь.
Атомна орбіталь - одноцентрова, одноелектронна хвильова функція, що описує стан електрона в ефективному полі ядра та інших електронів атома.
Молекулярна орбіталь - багатоцентрова, одноелектронна хвильова функція, що описує стан електрона в полі багатьох ядер та електронів молекулярної системи.
Базисні орбіталі - формально визначені за допомогою спрощених рівнянь орбіталі, лінійна комбінація яких дозволяє описати атомні та молекулярні орбіталі в лінійному наближенні.
Для розрахунку повної енергії молекулярних систем використовують деякі наближення.
Повна енергія молекулярних систем у наближенні Борна-Оппенгеймера - енергія молекулярної системи без урахування кінетичної енергії руху ядер.
МО ЛКАО - наближення, в якому кожна молекулярна орбіталь розглядається у вигляді лінійної комбінації атомних орбіталей.
Валентне наближення розрахунку електронної структури - наближення, в якому враховуються лише валентні електрони.
Електронна енергія молекулярних систем - сума потенціальних енергій взаємодій: електрон-електрон, електрон-ядро; та кінетичних енергій руху кожного електрона.
Стандартна ентальпія утворення молекулярних систем - термодинамічна характеристика, що являє собою тепловий ефект реакції утворення даної сполуки з простих речовин.
Ядерно-електронний «остов» - поняття, яке використовується в квантовохімічних розрахунках валентного наближення. У такому наближенні допускається, що атомне ядро та невалентні електрони атома утворюють атомний (ядерно-електронний) остов, заряд визначається сумуванням заряду атомного ядра та заряду всіх невалентних електронів.
Валентні електрони - електрони, здатні до утворення хімічних зв'язків.
Граничні МО - найвища зайнята молекулярна орбіталь та найнижча вільна молекулярна орбіталь.
НЗМО - молекулярна орбіталь, що має найвищу енергію з усіх зайнятих електронами МО.
НВМО - молекулярна орбіталь, що має найнижчу енергію з усіх незаселених електронами молекулярних орбіталей хімічної частинки.
Потенціал іонізації (за теоремою Купманса) - це енергія НЗМО, взята с протилежним знаком.
Спорідненість до електрону - властивість молекул приєднувати електрон; визначається енергією, що виділяється при приєднанні електрона до молекули з утворенням аніон-радикалу.
Електронна густина - число електронів в одиниці об'єму.
Електричний заряд на атомі - розраховується за виразом: qA = ZA - QA, де: ZA - заряд ядра атома А, QA - електронна густина на атомі А.
Довжина хімічного зв'язку - відстань у рівноважному стані між положеннями ядер атомів, сполучених хімічним зв'язком.
Торсійний кут - стереохімічний елемент молекулярної структури (двогранний кут).
Електронна заселеність (АО) - вирахуване число електронів на певній атомній орбіталі, яка центрована на атомі А.
Дипольний момент - вектор, що характеризує зарядову асиметрію і умовно спрямований від центра негативного до центра позитивного заряду.
Варіаційні коефіцієнти - коефіцієнти, що показують внесок атомної орбіталі в загальну хвильову функцію.
Вікове рівняння - рівняння виду:
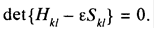
Мета. Освоєння методики визначення стереохімічних параметрів та електронної будови молекулярних систем за результатами квантовохімічних розрахунків (метод MNDO).
Завдання до роботи.
1. Дати структурно хімічну характеристику молекули.
2. Освоїти організацію структури файлу вхідних даних для квантовохімічного розрахунку.
3. Освоїти організацію структури архівного (arc) файлу результатів квантовохімічного розрахунку.
4. Освоїти організацію структури архівного (оut) файлу результатів квантовохімічного розрахунку.
5. Параметри молекулярної геометрії та електронної структури конформерів занести в таблицю.
6. Провести аналіз впливу конформації пероксикислот на параметри їх молекулярної геометрії та електронної структури.
 2020-04-20
2020-04-20 115
115








