| Тест или субстрат | Реакция через 18-24 часа культивирования при 37°С | Максимальные сроки учета результатов в случаях замедленных реакций (в сутках) | |
| положительная | отрицательная | ||
| Подлинность | помутнение среды, диффузное или в отдельных участках вдоль укола | среда остается прозрачной, рост строго по ходу укола | 2 (с инкубацией посевов при 22°С) |
| Сероводород (в среде Олькеницкого или Клиглера) | почернение в разной степени по всей среде или в отдельных участках | отсутствие почернения в среде | |
| Индол (с применением индикаторной бумажки) | покраснение индикаторной бумажки | отсутствие изменения цвета индикаторной бумажки | |
| Фенилаланиндезаминаза | зеленое окрашивание агаровой поверхности среды после добавления нескольких капель 10% раствора железа (III) хлорида 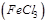
| ||
| Мочевина по Преусу* | синее окрашивание среды | пожелтение среды | 2 |
| Мочевина по Кристенсену | малиновое окрашивание среды | отсутствие изменения цвета | 4 |
| Ацетат натрия* | наличие роста и синее окрашивание среды | отсутствие роста и изменения цвета среды | 4 (редко до 7) |
| Цитрат Симонса* | наличие роста и синее окрашивание среды | отсутствие и роста и изменения цвета среды | 4 (редко до 14) |
| Реакция с метиловым красным в среде Кларка | красное окрашивание среды после добавления реактива метилового красного | желтое окрашивание среды после добавления реактива метилового красного | 2-4 |
| Реакция Фогеса-Проскауэра | вишневое окрашивание среды после добавления реактивов (альфа-нафтола и КОН) | отсутствие изменения цвета среды после добавления реактивов (альфа-нафтола и КОН) | 2-4 |
| Среды с аминокислотами (лизином, орнитином, аргинином) | синее (при индикаторе бромтимол синий) или фиолетовое (при индикаторе бромкрезол пурпуровый) окрашивание среды при отсутствии указанных окрашиваний в контрольной пробирке | отсутствие синего (фиолетового) окрашивания сред с аминокислотами, желтое окрашивание в контрольной пробирке | 4 |
| Малонат натрия* | синее окрашивание среды | отсутствие изменения цвета | 2 |
| Цитрат Кристенсена | розово-красное окрашивание среды | отсутствие изменения цвета | 4 |
| Желатин | разжижение среды, не исчезающее после часового охлаждения в рефрижераторе (4-6°С) | отсутствие разжижения среды или его исчезновение после часового охлаждения в рефрижераторе (4-6°С) | 30 |
| Среды с углеводами | синее или розовое, красное (в зависимости от индикатора) окрашивание среды | отсутствие изменения цвета | 30 |
Примечание. * Указаны изменения цвета при индикаторе бромтимоловый синий.
Посевы для воспроизведения других тестов не требуют специальных пояснений, учет результатов см. табл. 9.
На этапе дифференциации родов могут быть использованы пробы с поливалентными сальмонеллезными и дизентерийным бактериофагами (диагностические жидкие или лечебные в таблетках). Таблетку лечебного фага перед постановкой пробы растворяют в 20 мл ИХН. Для воспроизведения пробы с фагом используют 2-х или 18-часовую бульонную культуру, можно применять также взвесь суточной агаровой культуры в ИХН. Тонко оттянутой пастеровской пипеткой или петлей диаметром 4-5 мм наносят две капли испытуемой культуры на хорошо подсушенный СПА в чашке Петри. На одну из капель после подсыхания наносят петлей или из очень тонкого капилляра пастеровской пипетки каплю фага, а на другую (служащую контролем) - каплю стерильного бульона. Бактериофаг применяют в неразведенном виде или в разведениях в соответствии с "Наставлением" к препарату. После постановки пробы чашки инкубируют при 37°C в течение 18-20 часов. При положительной реакции на месте нанесения фага появляется четко очерченный лизис (++++), полусливной лизис (+++), большее или меньшее число отдельных негативных колоний (++, +). При отсутствии лизиса (отрицательная реакция) в местах нанесения фага, как и в контроле, наблюдают сплошной рост культуры.
Как указывалось ранее, на этапе дифференциации родов возможна постановка ориентировочных серологических проб с поливалентными агглютинирующими сыворотками к сальмонеллам и шигеллам. При этом используют соответственно поливалентную смесь к сальмонеллам групп ABCDE (при отрицательном результате пробу повторяют со смесью O-сывороток к сальмонеллам редких групп) и поливалентную смесь сывороток к S. sonnei, S. flexneri 1-5, S. flexneri 6. Указанные ориентировочные пробы выполняют путем постановки реакции агглютинации на стекле с культурой, выросшей на среде первичной идентификации. В ходе исследования на ЭПЭ, как указывалось ранее, при отборе соответствующих колоний, давших агглютинацию с OKA сывороткой, делают посев не только на среду первичной идентификации, но и на скошенный СПА. Серологическое изучение эшерихий проводят с культурами, выращенными на скошенном СПА. Культуры, подозреваемые на принадлежность к ЭПЭ, исследуют повторно с поливалентной сывороткой OKA и при положительном результате - с OKB, OKC, OKD, OKE или соответствующими OK-иммуноглобулинами. При наличии положительной реакции культуру засевают в среды минимального дифференцирующего ряда (табл. 7) для подтверждения принадлежности культуры к роду Escherichia (в первую очередь ацетатную, цитратную Кристенсена и на подвижность).
Помимо постановки тестов, необходимых для установления родовой принадлежности выделенной культуры энтеробактерий, со среды первичной идентификации делают также высев на скошенный СПА, используемый для дальнейшей биохимической и серологической идентификации.
 2020-06-12
2020-06-12 154
154








