При замене мостикового кислорода пиросерной кислоты на перекисную группу -О-О- образуется пероксодисерная кислота H2S2O8 (рис.9, направление IV). Ее синтезируют электролизом водного раствора H2SO4: 2 H2SO4 + 2 
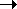 H2S2O8 + 2Н+, а наиболее важные соли, пероксодисульфаты (персульфаты) K2S2O8и (NH4)2 S2O8, - анодным окислением сульфатов: 2KHSO4 = K2S2O8 + H2 .
H2S2O8 + 2Н+, а наиболее важные соли, пероксодисульфаты (персульфаты) K2S2O8и (NH4)2 S2O8, - анодным окислением сульфатов: 2KHSO4 = K2S2O8 + H2 .
Структура иона  представляет собой 2 тетраэдра SO4, соединенных между собой пероксидной группой -О-О. Кислота смешивается с водой в любых пропорциях. Реакция взаимодействия с водой используется для получения перекиси водорода:
представляет собой 2 тетраэдра SO4, соединенных между собой пероксидной группой -О-О. Кислота смешивается с водой в любых пропорциях. Реакция взаимодействия с водой используется для получения перекиси водорода:
H2S2O8 + 2 H2O 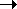 2H2SO4 + H2O2.
2H2SO4 + H2O2.
Соли пероксодисерной кислоты - сильнейшие окислители:


Ион  в присутствии катализатора окисляет ион Mn2+ непосредственно в перманганат:
в присутствии катализатора окисляет ион Mn2+ непосредственно в перманганат:  .
.
При замене атома кислорода гидроксильной группы в H2SO4 на перекисную группу образуется пероксомоносерная кислота H2SO5 (рис.9, направление V). Безводную H2SO5 получают при взаимодействии хлоросерной кислоты с безводной перекисью водорода: HOOH + ClSO2(OH) 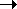 HOOSO2(OH) + HCl, а также при действии концентрированной H2SO4 на пероксодисульфаты:
HOOSO2(OH) + HCl, а также при действии концентрированной H2SO4 на пероксодисульфаты:  . Кислота H2SO5 является одноосновной, так как атом Нпероксидной группировки не диссоциирует. H2SO5 активно взаимодействует с водой: H2SO5+ H2O
. Кислота H2SO5 является одноосновной, так как атом Нпероксидной группировки не диссоциирует. H2SO5 активно взаимодействует с водой: H2SO5+ H2O 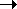 H2SO4 + H2O2. В кристаллическом виде взрывоопасна. Ее соли термически мало устойчивы и при нагревании отщепляют кислород. При замещении гидроксильной группы серной кислоты на изоэлектронные группы F-, Cl- (рис.9, направление VI) образуются соответственно фтор- (F(OH)SO2)и хлорсульфоновая (Cl(OH)SO2) кислоты. Практически их синтезируют взаимодействием галогеноводородных кислот HF (HCl) с жидким SO3. Фторсульфоновая кислота в отличие от хлорсульфоновой практически не гидролизуется водой. Введение фтора из-за усиления поляризации связи О- Н приводит к повышению силы фторсульфоновой кислоты.
H2SO4 + H2O2. В кристаллическом виде взрывоопасна. Ее соли термически мало устойчивы и при нагревании отщепляют кислород. При замещении гидроксильной группы серной кислоты на изоэлектронные группы F-, Cl- (рис.9, направление VI) образуются соответственно фтор- (F(OH)SO2)и хлорсульфоновая (Cl(OH)SO2) кислоты. Практически их синтезируют взаимодействием галогеноводородных кислот HF (HCl) с жидким SO3. Фторсульфоновая кислота в отличие от хлорсульфоновой практически не гидролизуется водой. Введение фтора из-за усиления поляризации связи О- Н приводит к повышению силы фторсульфоновой кислоты.
§ 14. Галогениды халькогенов.
Среди различных классов соединений халькогенов их галогениды наиболее многочисленны и разнообразны. Синтезированы и выделены галогенидные соединения, содержащие атомы халькогенов в различных степенях окисления - от низших (SnCl2 и SnBr2 (n = 3-8), Te3Cl2, S2X2 и Se2X2 (X = F, Cl, Br), TeI) до высших (ЭF6). Прочность химических связей сера-галоген (табл.10) понижается от Fк I, благодаря чему, например, не образуются бинарные иодиды серы и селена:
 2020-06-29
2020-06-29 129
129








