Следует учесть, что в соответствии с одним из правил Хунда вначале электронами заполняются орбитали с бóльшими положительными значениями магнитного квантового числа 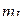 .
.
Пример 3. Охарактеризуйте квантовыми числами состояние электронов 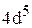 .
.
Ответ. Электронная конфигурация 4d означает, что для всех пяти d-электронов главное квантовое число n = 4, а побочное квантовое число 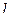 = 2. Следовательно, квантовое состояние электронов будет следующее:
= 2. Следовательно, квантовое состояние электронов будет следующее:
| № электрона | n | 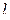
| 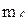
| 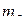
|
| 1 | 4 | 2 | 2 | 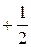 или или 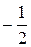
|
| 2 | 4 | 2 | 1 | 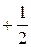 или или 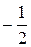
|
| 3 | 4 | 2 | 0 | 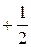 или или 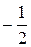
|
| 4 | 4 | 2 | –1 | 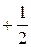 или или 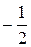
|
| 5 | 4 | 2 | –2 | 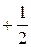 или или 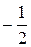
|
Пример 4. Приведите электронные формулы атома меди, катиона 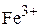 и
и 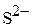 .
.
Ответ. Энергии электронных состояний 3d и 4s довольно близки друг к другу. Однако энергия 3d-оболочки уменьшается с ростом заряда ядра значительнее, чем энергия 4s-оболочки. Этим фактом обычно объясняют реальную электронную конфигурацию атома меди: если энергия 3d-подуровня становится меньше, чем энергия 4s-подуровня при Z = 29, то основное состояние атома меди определяется электронной формулой 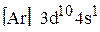 , а не конфигураций
, а не конфигураций 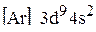 , т.е. один из s-электронов с 4s-орбитали переходит на 3d-орбиталь с более низким значением энергии.
, т.е. один из s-электронов с 4s-орбитали переходит на 3d-орбиталь с более низким значением энергии.
При ионизации в первую очередь из атома удаляются те электроны, которые требуют для этого меньших энергетических затрат. Если n s-подуровень заполняется раньше, чем (n –1)d- и (n –2)f-подуровни, то порядок ионизации электронов, казалось бы, должен быть обратным порядку заселения орбиталей электронами. Однако имеются исключения для атомов переходных элементов. Так, например, переходные элементы IV периода образуют двухзарядные катионы, теряя два 4s-электрона:
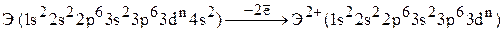 ,
,
т.е. первые потенциалы ионизации у атомов d-элементов IV периода всегда являются s-потенциалами.
Так, например, величины первой, второй и третьей энергий ионизации атома железа и его катионов (в МДж/моль) составляют соответственно: 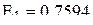 (отрыв первого 4s-электрона);
(отрыв первого 4s-электрона); 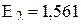 (отрыв второго 4s-электрона);
(отрыв второго 4s-электрона); 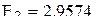 (отрыв третьего электрона с 3d-орбитали).
(отрыв третьего электрона с 3d-орбитали).
Напомним, что величина энергии ионизации атома определяется эффектами экранирования заряда ядра электронами и проникновения орбитали к ядру. Сказанное справедливо и для элементов последующих периодов: n 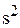 -электроны (n = 5, 6) ионизируются раньше, чем (n –1)d- или (n –2)f-электроны.
-электроны (n = 5, 6) ионизируются раньше, чем (n –1)d- или (n –2)f-электроны.
Таким образом, электронные конфигурации атома железа и катиона 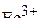 следующие:
следующие:
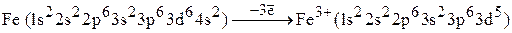 .
.
Электронная конфигурация аниона 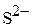 такова:
такова:
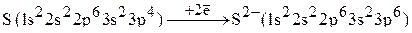 .
.
Пример 5. Указать максимальное число электронов в атоме, которые могут иметь одинаковые квантовые числа:
а) n, 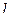 ,
,  ;
;
б) n,  ;
;
в) n.
Ответ. а) Каждая орбиталь характеризуется тремя квантовыми числами n, 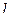 и
и 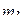 , на которой могут находиться два электрона с противоположными значениями
, на которой могут находиться два электрона с противоположными значениями 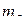 . Следовательно, два электрона в атоме могут иметь одинаковые значения главного, побочного и магнитного квантовых чисел.
. Следовательно, два электрона в атоме могут иметь одинаковые значения главного, побочного и магнитного квантовых чисел.
б) Каждая оболочка характеризуется определённым набором квантовых чисел n и 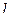 . Например, для оболочки 1s n = 1,
. Например, для оболочки 1s n = 1, 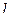 = 0; для оболочки 4d n = 4,
= 0; для оболочки 4d n = 4, 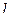 = 2. Число орбиталей в оболочке определяется формулой (2
= 2. Число орбиталей в оболочке определяется формулой (2 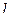 +1). Так, число орбиталей в любой s-оболочке равно (2·0 + 1) = 1, в любой d-оболочке составляет (2·2 + 1) = 5. Так как каждая орбиталь максимально может содержать два электрона, то в атоме максимальное число электронов с одинаковыми квантовыми числами n и
+1). Так, число орбиталей в любой s-оболочке равно (2·0 + 1) = 1, в любой d-оболочке составляет (2·2 + 1) = 5. Так как каждая орбиталь максимально может содержать два электрона, то в атоме максимальное число электронов с одинаковыми квантовыми числами n и 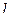 равно 2(2
равно 2(2 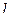 + 1), т.е.
+ 1), т.е. 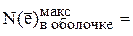 2(2
2(2 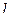 + 1).
+ 1).
в) Совокупность электронов с одинаковым значением главного квантового числа n составляет электронный слой, который может содержать одну (n = 1), две (n = 2), три (n = 3), четыре (n = 4) оболочки. Электронный слой, характеризующийся значением главного квантового числа n = 5. содержит следующие оболочки: s (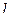 = 0), р (
= 0), р ( = 1), d (
= 1), d ( = 2), f (
= 2), f ( = 3), g (
= 3), g ( = 4). Максимальное значение
= 4). Максимальное значение 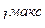 = (n – 1). Для того, чтобы вычислить максимальное число электронов в атоме с данным значением n, нужно вычислить суммарное возможное число электронов во всех оболочках данного электронного слоя, т.е. вычислить сумму
= (n – 1). Для того, чтобы вычислить максимальное число электронов в атоме с данным значением n, нужно вычислить суммарное возможное число электронов во всех оболочках данного электронного слоя, т.е. вычислить сумму 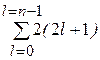 , которая составит
, которая составит 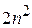 . Таким образом,
. Таким образом, 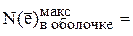
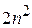 .
.
Пример 6. Определить максимальное число электронов в полностью заполненном слое атома (n = 3 или n = 4), у которых одинаковы следующие квантовые числа:
а) 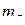 ;
;
б) 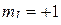 ;
;
в) 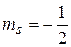 и
и 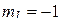 .
.
Ответ. а) 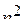 ; б)
; б) 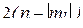 ; в)
; в) 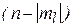 .
.
Вариант 1
1. Что называется электронным слоем? Вычислить максимально возможное число электронов в атоме, характеризующихся значением главного квантового числа n = 4.
2. Какие возможные значения может принимать побочное квантовое число 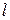 , если главное квантовое число n = 5?
, если главное квантовое число n = 5?
3. Охарактеризовать квантовыми числами электроны атома фтора в основном состоянии.
4. Изобразить полярные диаграммы электронных орбиталей для состояний 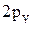 ,
, 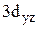 и
и 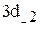 Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода
Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода 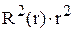 для состояния 3р от расстояния электрона до ядра r.
для состояния 3р от расстояния электрона до ядра r.
5. Установить, для атома какого элемента, находящемся в основном состоянии, приведена электронная формула: 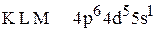 .
.
6. Привести электронные формулы ионов 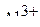 и
и 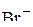 .
.
Вариант 2
1. Что называется электронной оболочкой? По какой формуле можно вычислить максимальное число электронов в оболочке? Какое максимальное число электронов могут содержать s-, p-, d-, f-оболочки?
2. Какие возможные значения может принимать магнитное квантовое число 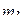 , если побочное квантовое число
, если побочное квантовое число 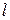 = 4?
= 4?
3. Охарактеризовать квантовыми числами электроны атома кислорода в основном состоянии.
4. Изобразить полярные диаграммы электронных орбиталей 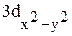 ,
, 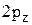 и 1s. Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода
и 1s. Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода 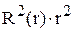 для состояния 2s от расстояния электрона до ядра r.
для состояния 2s от расстояния электрона до ядра r.
5. Установить, для атома какого элемента, находящегося в основном состоянии, приведена электронная формула: 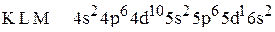 .
.
6. Привести электронные формулы ионов 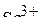 и
и 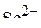 .
.
Вариант 3
1. Каков физический смысл главного квантового числа n? Какие значения оно может принимать?
2. Какие возможные значения может принимать магнитное квантовое число 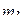 , если главное квантовое число n = 4?
, если главное квантовое число n = 4?
3. Охарактеризовать квантовыми числами электроны атома натрия в основном состоянии.
4. Изобразить полярные диаграммы электронных орбиталей для состояний 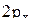 ,
, 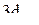 и
и 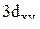 . Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода
. Привести график зависимости функции радиального распределения вероятности нахождения электрона в атоме водорода 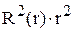 для состояния 2p от расстояния электрона до ядра r.
для состояния 2p от расстояния электрона до ядра r.
5. Установить, для атома какого элемента, находящегося в основном состоянии, приведена электронная формула: 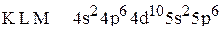 .
.
6. Привести электронные формулы ионов 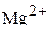 и
и 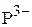 .
.
Вариант 4
1. Каков физический смысл побочного квантового числа 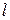 ? Какие значения оно может принимать?
? Какие значения оно может принимать?
2. Привести возможные значения квантовых чисел 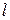 ,
,  и
и 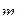 для электрона в атоме водорода, главное квантовое число которого n = 3.
для электрона в атоме водорода, главное квантовое число которого n = 3.
3. Охарактеризовать квантовыми числами d-электроны атома кобальта в основном состоянии.
4. Какие узловые поверхности имеют орбитали электрона, находящегося в состояниях 2s, 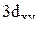 ?
?
5. Установить, для атома какого элемента, находящегося в основном состоянии, приведена электронная формула: 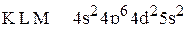 .
.
6. Привести электронные формулы ионов 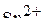 и
и 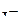 .
.
Вариант 5
1. Каков физический смысл магнитного квантового числа 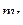 и магнитного спинового квантового числа
и магнитного спинового квантового числа 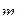 ? Какие значения он могут принимать?
? Какие значения он могут принимать?
2. Электрон в атоме водорода, находящемся в возбуждённом состоянии, характеризуется значением главного квантового числа n = 3. Каковы возможные значения квантовых чисел 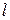 ,
,  и
и 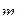 для этого электрона.
для этого электрона.
3. Охарактеризовать квантовыми числами электроны атома алюминия в основном состоянии.
4. Какие узловые поверхности имеют орбитали электрона, находящегося в состояниях 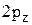 ,
, 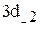 ?
?
5. Установить, для атома какого элемента, находящегося в основном состоянии, приведена электронная формула: 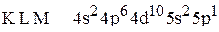 .
.
6. Привести электронные формулы ионов 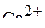 и
и 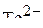 .
.
7. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ГИБРИДИЗАЦИЯ ОДНОЭЛЕКТРОННЫХ ВОЛНОВЫХ ФУНКЦИЙ. σ– и π– СВЯЗИ. МЕТОД НАЛОЖЕНИЯ ВАЛЕНТНЫХ СХЕМ
Пример 1. Привести выражения волновых функций для двух гибридных sp-орбиталей и изобразить для них полярные диаграммы.
Решение. Волновые функции гибридных sp-орбиталей имеют следующий вид:
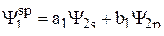 , (1)
, (1)
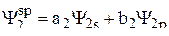 . (2)
. (2)
Здесь 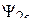 и
и 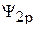 – волновые функции атомных орбиталей 2s и 2p; аналитический вид этих волновых функций известен из результатов решения уравнения Шредингера. Величины
– волновые функции атомных орбиталей 2s и 2p; аналитический вид этих волновых функций известен из результатов решения уравнения Шредингера. Величины 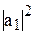 ,
, 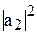 ,
, 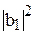 ,
, 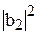 характеризуют вклад чистых атомных орбиталей в гибридную орбиталь.
характеризуют вклад чистых атомных орбиталей в гибридную орбиталь.
С точки зрения смысла уравнения Шредингера коэффициенты уравнений (1) и (2) могут быть любыми: если две волновые функции 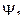 и
и 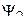 отвечают одному и тому же значению энергии, то результатом решения уравнения Шредингера будет их линейная комбинация. Полинг распространил это положение и на вывод аналитического выражения для гибридных орбиталей: если две волновые функции 2s и 2p отвечают примерно одинаковому значению энергии, то решением уравнения Шредингера будет их линейная комбинация.
отвечают одному и тому же значению энергии, то результатом решения уравнения Шредингера будет их линейная комбинация. Полинг распространил это положение и на вывод аналитического выражения для гибридных орбиталей: если две волновые функции 2s и 2p отвечают примерно одинаковому значению энергии, то решением уравнения Шредингера будет их линейная комбинация.
Таким образом, гибридизация не является реально протекающим физическим процессом (совершенно бессмысленно утверждение «гибридизация орбиталей происходит»), а сводится к математической задаче нахождения коэффициентов уравнений (1) и (2).
Эти коэффициенты следует выбирать такими, чтобы они удовлетворяли рассматриваемой задаче, а именно, новые гибридные волновые функции должны быть нормированы, т.е.
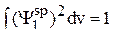 , (3)
, (3)
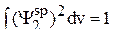 . (4)
. (4)
Тогда уравнение (3) преобразуется к виду
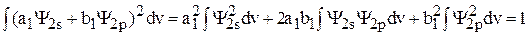 . (5)
. (5)
В уравнении (5) первый и последний интегралы равны 1 (из условия нормировки), а второй интеграл равен 0 вследствие ортогональности волновых функций. В этом случае из уравнения (5) имеем
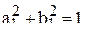 . (6)
. (6)
Аналогичное уравнение можно получить и для коэффициентов 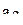 и
и 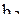 из условия нормировки гибридной волновой функции
из условия нормировки гибридной волновой функции 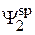 , т.е.
, т.е.
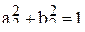 . (7)
. (7)
Третье уравнение для нахождения коэффициентов  и
и 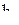 даёт условие ортогональности гибридных волновых функций; интеграл ортогональности имеет вид:
даёт условие ортогональности гибридных волновых функций; интеграл ортогональности имеет вид:
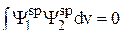 . (8)
. (8)
Следовательно,
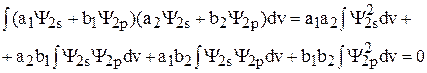 (9)
(9)
Так как волновые функции ортогональны и нормированы, то 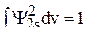 ,
, 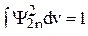 , а
, а 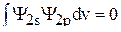 . Таким образом, из уравнения (9) получаем третье уравнение для вычисления коэффициентов
. Таким образом, из уравнения (9) получаем третье уравнение для вычисления коэффициентов
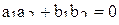 . (10)
. (10)
Четвёртое уравнение получаем из условия, что гибридные орбитали должны быть эквивалентны, т.е.
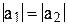 и
и 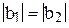 . (11)
. (11)
Решая систему четырёх уравнений (6), (7), (10), (11), получаем значения коэффициентов 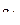 ,
, 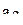 ,
, 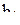 и
и 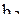 :
:
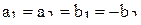 ;
; 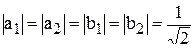 . (12)
. (12)
Таким образом, выражения для гибридных волновых функций имеют следующий вид:
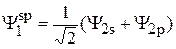 , (13)
, (13)
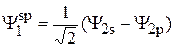 . (14)
. (14)
Аналогичным образом выводятся уравнения и для других гибридных орбиталей. Например, в случае четырёх 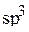 -гибридных орбиталей
-гибридных орбиталей
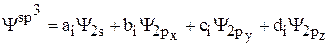
необходимо вычислить 16 значений коэффициентов  ,
,  ,
, 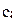 ,
, 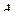 .
.
Как известно, при решении уравнения Шредингера методом разделения переменных находят радиальную часть волновой функции 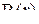 , зависящую от расстояния электрона до ядра r, и угловую часть
, зависящую от расстояния электрона до ядра r, и угловую часть 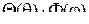 , зависящую от угла долготы
, зависящую от угла долготы 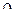 и угла широты
и угла широты 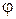 . Результаты решения уравнения Шредингера приводятся в справочниках. Пользуясь ими, можно вычислить численное значение угловой части волновой функции
. Результаты решения уравнения Шредингера приводятся в справочниках. Пользуясь ими, можно вычислить численное значение угловой части волновой функции 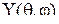 . Форма орбитали (атомной или гибридной) определяется угловой частью волновой функции или её квадратом.
. Форма орбитали (атомной или гибридной) определяется угловой частью волновой функции или её квадратом.
Для плоскостного изображения формы орбитали достаточно вычислить значения угловой части 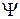 при различных значениях угла долготы
при различных значениях угла долготы 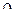 , выбрав такое значение угла широты (0º или 90º), чтобы широтная часть
, выбрав такое значение угла широты (0º или 90º), чтобы широтная часть 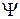 равнялась бы единице (эта часть волновой функции содержит тригонометрические параметры
равнялась бы единице (эта часть волновой функции содержит тригонометрические параметры  и
и 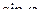 ).
).
Далее на лучах, проведённых под произвольными углами 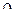 относительно координатных осей,
относительно координатных осей,
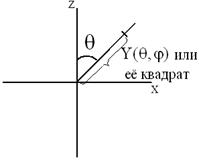
откладываются отрезки, пропорциональные либо угловой части волновой функции, либо её квадрату в интервале значений  от 0º до 360º. Полученные «засечки» на лучах затем соединяются плавной линией, в результате чего получается плоскостное изображение формы гибридных орбиталей.
от 0º до 360º. Полученные «засечки» на лучах затем соединяются плавной линией, в результате чего получается плоскостное изображение формы гибридных орбиталей.
При линейной комбинации  -функций с одинаковым знаком 2s-орбитали и 2p-орбитали (например,
-функций с одинаковым знаком 2s-орбитали и 2p-орбитали (например,  -орбитали)
-орбитали)
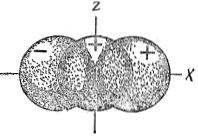
происходит усиление положительной части 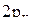 -орбитали и уменьшение отрицательной части, в результате чего форма одной из гибридных sp-орбиталей имеет вид:
-орбитали и уменьшение отрицательной части, в результате чего форма одной из гибридных sp-орбиталей имеет вид:
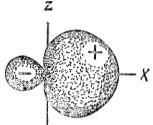
При наложении областей с различным знаком 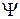 -функций происходит уменьшение абсолютного значения суммарной
-функций происходит уменьшение абсолютного значения суммарной 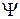 -функции, т.е. форма второй гибридной sp-орбитали имеет вид:
-функции, т.е. форма второй гибридной sp-орбитали имеет вид:
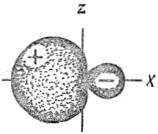
Таким образом, две sp-гибридные орбитали располагаются линейно в пространстве под углом 180º.
Пример 2. Изобразить схему перекрывания орбиталей при образовании связей в молекулах 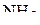 и
и 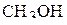 .
.
Решение. Электронное строение молекулы 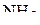 можно изобразить в виде схемы
можно изобразить в виде схемы
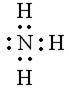 ,
,
согласно которой атом азота имеет неподелённую электронную пару. Электронная конфигурация атома азота – 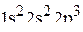 .
.
Электроны валентного слоя будут занимать четыре 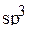 -гибридные орбитали, три из которых содержат по одному электрону. Эти три орбитали образуют связи
-гибридные орбитали, три из которых содержат по одному электрону. Эти три орбитали образуют связи 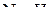 вследствие перекрывания с s-орбиталями атомов водорода. Четвертая
вследствие перекрывания с s-орбиталями атомов водорода. Четвертая 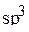 -гибридная орбиталь будет занята электронной парой, не образующей химическую связь с атомами Н. Таким образом, схему перекрывания орбиталей атома азота с орбиталями атомов водорода можно изобразить следующим образом:
-гибридная орбиталь будет занята электронной парой, не образующей химическую связь с атомами Н. Таким образом, схему перекрывания орбиталей атома азота с орбиталями атомов водорода можно изобразить следующим образом:
 2020-09-24
2020-09-24 260
260








