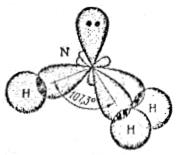
В молекуле 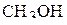 атом углерода находится в
атом углерода находится в 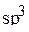 -гибридном состоянии. Четыре
-гибридном состоянии. Четыре 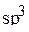 -гибридных орбитали образуют три связи
-гибридных орбитали образуют три связи 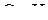 и одну связь
и одну связь  . Связь
. Связь 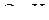 образуется за счёт перекрывания p-орбитали атома кислорода с s-орбиталью атома водорода. Схему перекрывания орбиталей при образовании связей в молекуле
образуется за счёт перекрывания p-орбитали атома кислорода с s-орбиталью атома водорода. Схему перекрывания орбиталей при образовании связей в молекуле 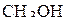 можно изобразить следующим образом:
можно изобразить следующим образом:
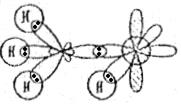
Пример 3. Указать число σ- и π-связей в молекулах 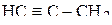 и
и 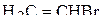 .
.
Решение. Любая одинарная связь в молекуле соединения является σ-связью, которая образована электронным облаком, имеющим максимальную плотность на линии, соединяющей ядра атомов.
Любая кратная связь содержит одну σ-связь и одну или две π-связи (они образуются электронами, орбитали которых дают максимальное перекрывание по обе стороны от линии, соединяющей ядра атомов).
В соответствии с формулами соединений
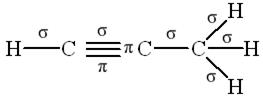 | 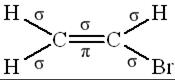 |
в молекуле пропина шесть σ-связей и две π-связи, а в молекуле бромистого винила пять σ-связей и одна π-связь.
Пример 4. Изобразить схему перекрывания орбиталей при образовании σ- и π-связей в молекулах HCHO и 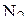 .
.
Решение. В соответствии с формулой
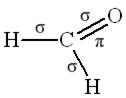
атом углерода в молекуле формальдегида образует три σ-связи за счёт перекрывания трёх 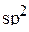 -гибридных орбиталей с s-орбиталями атомов водорода и p-орбиталью атома кислорода. Эти три σ-связи располагаются в одной плоскости под углами 120º друг к другу. Четвёртая атомная p-орбиталь атома углерода образует π-связь с атомом кислорода. π-Связь располагается в плоскости, перпендикулярной той, в которой располагаются три σ-связи. Таким образом, схема перекрывания орбиталей при образовании связей в молекуле формальдегида выглядит так:
-гибридных орбиталей с s-орбиталями атомов водорода и p-орбиталью атома кислорода. Эти три σ-связи располагаются в одной плоскости под углами 120º друг к другу. Четвёртая атомная p-орбиталь атома углерода образует π-связь с атомом кислорода. π-Связь располагается в плоскости, перпендикулярной той, в которой располагаются три σ-связи. Таким образом, схема перекрывания орбиталей при образовании связей в молекуле формальдегида выглядит так:
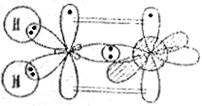
В молекуле азота одна σ-связь образуется за счёт перекрывания p-орбиталей атомов азота, две другие валентные p-орбитали атомов азота образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях:
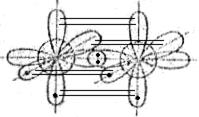
Однако образование химических связей в молекуле азота можно объяснить и с позиций гибридизации атомных орбиталей. При этом атомы азота находятся в sp-гибридном состоянии,
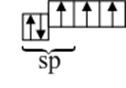
но одна sp-гибридная орбиталь содержит неподелённую пару электронов. σ-Связь в молекуле  реализуется в результате перекрывания двух гибридных sp-орбиталей атомов азота, на которых находится по одному неспаренному электрону. Две p-орбитали, содержащие по одному неспаренному электрону, образуют две π-связи:
реализуется в результате перекрывания двух гибридных sp-орбиталей атомов азота, на которых находится по одному неспаренному электрону. Две p-орбитали, содержащие по одному неспаренному электрону, образуют две π-связи:
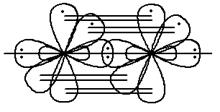
Пример 5. Изобразить валентные схемы для молекулы 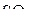 .
.
Решение. Как установлено методом дифракции электронов, молекула 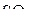 в газовой фазе представляет собой плоскую симметричную структуру с тремя расстояниями
в газовой фазе представляет собой плоскую симметричную структуру с тремя расстояниями  , равными 143 пм. Дипольный момент молекулы
, равными 143 пм. Дипольный момент молекулы 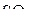 равен нулю.
равен нулю.
Одна из возможных валентных схем молекулы 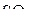 может быть представлена формулой
может быть представлена формулой
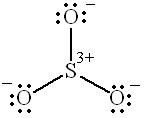 ,
,
в которой атом серы имеет незанятую р-орбиталь и обладает неполным октетом электронов. При этом три электрона атома серы делокализованы по одному на орбиталях атомов кислорода. Конечно, такая схема вносит наименьший вклад в суммарное распределение электронной плотности в молекуле, так как предполагает, что все связи  в молекуле
в молекуле  являются ионными.
являются ионными.
Возможны валентные схемы, которые содержат одну двойную связь  :
:
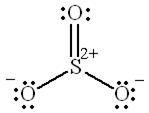 |  | 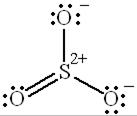 |
В данном случае два электрона атома серы делокализованы на р-орбитали двух атомов кислорода.
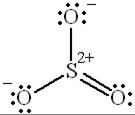
Наконец, возможны и валентные схемы, которые содержат две двойные связи  за счёт участия d-орбиталей атома серы в образовании химических связей:
за счёт участия d-орбиталей атома серы в образовании химических связей:
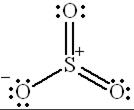 | 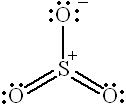 | 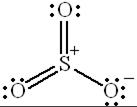 |
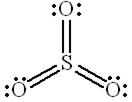
В реальной молекуле имеет место промежуточное распределение электронной плотности по сравнению с распределением, представленным с помощью валентных схем.
Пример 6. Указать связь, образованную в молекуле  по донорно-акцепторному механизму.
по донорно-акцепторному механизму.
Решение. Молекула  имеет следующее электронное строение
имеет следующее электронное строение
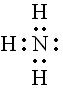 .
.
Согласно приведённой схеме три электронные пары образуют три связи 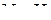 , а неподелённая пара внешних электронов принадлежит только атому азота. Молекула
, а неподелённая пара внешних электронов принадлежит только атому азота. Молекула 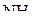 может присоединять частицы, имеющие незаселённые орбитали и, следовательно, способные принимать электронную пару, например, молекулу
может присоединять частицы, имеющие незаселённые орбитали и, следовательно, способные принимать электронную пару, например, молекулу 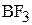 , в которой атом бора обладает незаполненной р-орбиталью.
, в которой атом бора обладает незаполненной р-орбиталью.
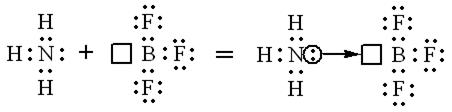
В молекуле соединения, образовавшейся в результате взаимодействия 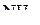 и
и 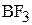 , атомы бора и азота четырёхвалентны. Связь, образованная по донорно-акцепторному механизму, условно обозначается стрелкой. Направление стрелки указывает перенос электронной пары от атома азота в молекуле
, атомы бора и азота четырёхвалентны. Связь, образованная по донорно-акцепторному механизму, условно обозначается стрелкой. Направление стрелки указывает перенос электронной пары от атома азота в молекуле 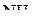 (донор) к атому бора (акцептор).
(донор) к атому бора (акцептор).
Вариант 1
1. Какой вид гибридизации валентных орбиталей атома А отвечает тетраэдрическому расположению связей в молекуле типа 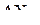 ?
?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах 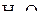 и
и 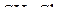 .
.
3. Указать число σ- и π-связей в молекулах HCHO и 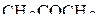 .
.
4. Изобразить схемы перекрывания орбиталей при образовании σ- и π-связей в молекулах 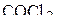 и
и 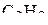 .
.
5. Изобразить валентные схемы для иона 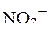 .
.
6. Указать число связей в молекуле 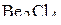 , образованных по донорно-акцепторному механизму.
, образованных по донорно-акцепторному механизму.
Вариант 2
1. Какова геометрическая форма молекулы  , если валентные орбитали атома А находятся в
, если валентные орбитали атома А находятся в 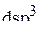 -гибридном состоянии?
-гибридном состоянии?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах 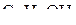 и
и 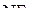 .
.
3. Указать число σ- и π-связей в молекулах 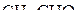 и
и 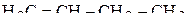 .
.
4. Изобразить схемы перекрывания орбиталей при образовании σ- и π-связей в молекулах 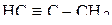 и
и 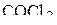 .
.
5. Изобразить валентные схемы для молекулы 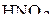 .
.
6. Указать число связей в молекуле 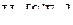 , образованных по донорно-акцепторному механизму.
, образованных по донорно-акцепторному механизму.
Вариант 3
1. Какой вид гибридизации валентных орбиталей атома А отвечает плоскому расположению связей в молекуле типа 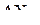 ?
?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах 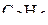 и
и 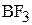 .
.
3. Указать число σ- и π-связей в молекулах 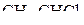 и
и 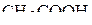 .
.
4. Изобразить схемы перекрывания орбиталей при образовании σ- и π-связей в молекулах 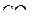 и
и 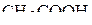 .
.
5. Изобразить валентные схемы для иона 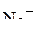 .
.
6. Указать число связей в ионе 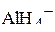 , образованных по донорно-акцепторному механизму.
, образованных по донорно-акцепторному механизму.
Вариант 4
1. Какой вид гибридизации валентных орбиталей атома А отвечает линейному расположению связей в молекуле типа 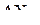 ?
?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах 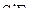 и
и 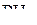 .
.
3. Указать число σ- и π-связей в молекулах 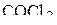 и
и 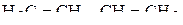 .
.
4. Изобразить схемы перекрывания орбиталей при образовании σ- и π-связей в молекулах 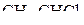 и
и 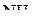 .
.
5. Изобразить валентные схемы для иона 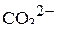 .
.
6. Указать число связей в ионе 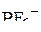 , образованных по донорно-акцепторному механизму.
, образованных по донорно-акцепторному механизму.
Вариант 5
1. Какой вид гибридизации валентных орбиталей атома А отвечает квадратному расположению связей в молекуле типа 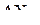 ?
?
2. Изобразить схемы перекрывания орбиталей при образовании связей в молекулах 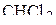 и
и 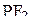 .
.
3. Указать число σ- и π-связей в молекулах 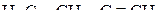 и
и 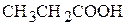 .
.
4. Изобразить схемы перекрывания орбиталей при образовании σ- и π-связей в молекулах HCN и 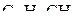 .
.
5. Изобразить валентные схемы для молекулы 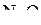 .
.
6. Указать число связей в молекуле 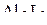 , образованных по донорно-акцепторному механизму.
, образованных по донорно-акцепторному механизму.
8. МОДЕЛЬ ОТТАЛКИВАНИЯ ЭЛЕКТРОННЫХ ПАР ВАЛЕНТНОЙ ОБОЛОЧКИ ЦЕНТРАЛЬНОГО АТОМА. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Введение
Геометрическая форма молекулы определяется равновесными расстояниями и пространственным расположением ядер атомов, образующих молекулу. Геометрическая конфигурация многоатомной молекулы не может быть вычислена с использованием строгого решения уравнений квантово-механическими методами.
Основные идеи модели отталкивания электронных пар валентной оболочки (ОЭПВО) впервые были высказаны Сиджвиком и Пауэллом ещё в 1940 г., а затем были сформированы совместно Гиллеспи и Найхолмом, когда в литературе были накоплены обширные экспериментальные данные о геометрии молекул.
Основные положения модели:
1) Атомный остов центрального атома (ядро и заполненные внутренние электронные оболочки) имеет сферическую форму и не влияет на расположение валентных электронов.
2) Каждая электронная пара валентного слоя центрального атома обозначается точкой, а их расположение на шаровой поверхности атомного остова определяет форму полиэдра, характеризующего геометрию молекулы.
3) Расположение химических связей вокруг любого атома определяется числом его валентных электронных пар.
4) При прочих равных условиях предпочтительное расположение электронных пар на поверхности сферы отвечает их максимальной удалённости друг от друга, независимо от того, являются ли эти электронные пары поделёнными (связывающими) или неподелёнными (свободными).
Обозначения, используемые в методе:
А – центральный атом;
Х – лиганд;
Е – неподелённая электронная пара;
n – число лигандов (число поделённых электронных пар);
m – число неподелённых электронных пар.
Таким образом, любая молекула в рамках данного метода может быть представлена формулой 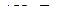 или
или 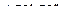 . В соответствии со сформулированными выше положениями модели ниже перечисленные частицы имеют следующую геометрическую форму:
. В соответствии со сформулированными выше положениями модели ниже перечисленные частицы имеют следующую геометрическую форму:
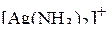 | – |  | – | линейная; |
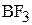 | – | 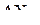 | – | плоская; |
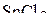 | – | 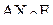 | – | угловая; |
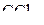 | – | 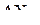 | – | тетраэдрическая; |
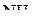 | – | 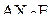 | – | тригональная пирамида; |
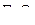 | – | 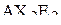 | – | угловая; |
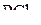 | – | 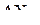 | – | тригональная бипирамида |
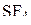 | – | 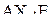 | – | бисфеноидныое строение (экватори-альное расположение неподелённой электронной пары в конфигурации тригональной бипирамиды, харак-терной для пяти электронных пар); |
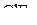 | – | 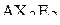 | – | Т-образная; |
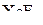 | – | 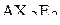 | – | линейная; |
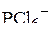 | – | 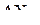 | – | октаэдрическая; |
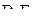 | – | 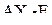 | – | квадратная пирамида; |
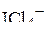 | – | 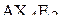 | – | квадратная; |
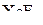 | – | 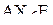 | – | искажённый октаэдр; |
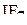 | – | 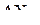 | – | пентагональная бипирамида. |
Молекулы с кратными связями
Кратные связи фактически не влияют на стереохимию молекулы. Её геометрическая форма определяется числом σ-связывающих и неподелённых пар электронов:
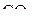 | – | 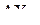 | – | линейная; |
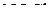 | – | 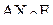 | – | угловая; |
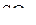 | – | 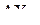 | – | плоская; |
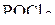 | – | 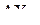 | – | тетраэдрическая; |
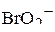 | – | 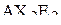 | – | угловая; |
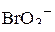 | – | 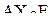 | – | тригональная пирамида; |
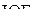 | – | 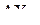 | – | октаэдрическая. |
Стереохимические обобщения
1. Неподелённые пары и валентные углы.
Неподелённая электронная пара находится под влиянием только одного атомного остова, поэтому она имеет несколько бóльший размер, чем облако связывающей пары, и стремится занимать больше места на поверхности сферы. Отсюда следует, что валентные углы связывающих пар будут меньше.
Отталкивание электронных пар растёт в следующем порядке:
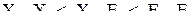 .
.
В связи с этим валентные углы в молекулах
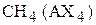 | 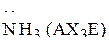 | 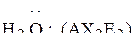 |
| 109,5º | 107,3º | 104,5º |
уменьшаются.
Именно более сильным отталкиванием электронных пар 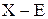 , чем
, чем 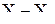 в молекуле
в молекуле 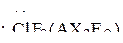 наблюдается искажение правильной Т-образной геометрической формы молекулы:
наблюдается искажение правильной Т-образной геометрической формы молекулы:
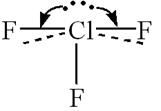 .
.
2. Электроотрицательность лигандов и валентные углы.
Отталкивание, вызываемое связывающей парой электронов, уменьшается при увеличении электроотрицательности связанного атома. С ростом электроотрицательности лиганда для связывающей электронной пары необходим всё меньший объём, и она всё слабее взаимодействует с соседними парами. Как следствие этого – уменьшение валентных углов:
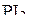 | 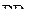 | 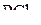 |  |
| 102º | 101,5º | 100,3º | 97,8º |
3. Электроотрицательность лигандов, кратные связи и валентные углы.
Если атом с заполненной валентной оболочкой, в которой есть одна или несколько пар электронов, связан с другим атомом, у которого валентная оболочка не заполнена или может стать незаполненной в результате электронного сдвига, то неподелённые пары первого атома стремятся частично перейти с заполненной оболочки на незаполненную оболочку второго атома, при этом образуется кратная связь:
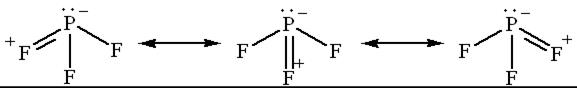
В области появления кратной связи электронная плотность повышена, значит, между связывающими парами связей P–F отталкивание увеличивается, что ведёт к увеличению угла в молекуле  по сравнению с молекулой
по сравнению с молекулой  (несмотря на то, что электроотрицательность атома фтора больше электроотрицательности атома водорода), в которой появление кратной связи невозможно:
(несмотря на то, что электроотрицательность атома фтора больше электроотрицательности атома водорода), в которой появление кратной связи невозможно:
 |  |
| 93,3º | 97,8º |
В молекулах  и
и 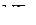 валентные углы составляют:
валентные углы составляют:
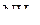 | 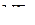 |
| 107,3º | 102,1º |
Отсутствие у атома азота d-оболочки не приводит к образованию кратной связи в молекуле 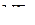 . Следовательно, изменение валентных углов в молекулах
. Следовательно, изменение валентных углов в молекулах 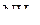 и
и 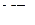 может быть объяснено стереохимическим обобщением 2, в то время как для молекулы
может быть объяснено стереохимическим обобщением 2, в то время как для молекулы 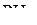 и
и  обобщение 2 неприемлемо.
обобщение 2 неприемлемо.
Пример 1. Изобразить структурные формулы Льюиса и классифицировать по методу ОЭПВО следующие молекулы: 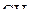 ,
, 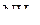 ,
, 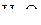 ,
,  ,
,  .
.
 2020-09-24
2020-09-24 1334
1334








