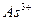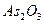1. Вода и все реактивы должны быть свободны от ионов, на содержание которых проводят испытания.
2. Пробирки, в которых проводят наблюдения, должны быть бесцветными и одинакового диаметра (около 1,5 см, если не указано иначе).
3. Навески для приготовления эталонных растворов отвешивают с точностью до 0,001 г.
4. Наблюдения мути и опалесценции растворов проводят в проходящем свете на темном фоне, а окраски – при дневном отраженном свете на матово-белом фоне.
5. Прибавление реактивов к испытуемому и эталонному растворам должно проводиться одновременно и в одинаковых количествах.
6. В случае, когда в соответствующей фармакопейной статье указано, что в данной концентрации раствора не должно обнаруживаться той или иной примеси, поступают следующим образом: к 10 мл испытуемого раствора прибавляют применяемые для каждой реакции реактивы, указанные в методике, кроме основного реактива, открывающего данную примесь. Затем раствор делят на две равные части: к одной из них прибавляют основной реактив и оба раствора сравнивают между собой. Отличий быть не должно.
Оценка степени чистоты лекарственного препарата – один из важных этапов фармацевтического анализа. Все лекарственные препараты, независимо от способа получения, испытывают на чистоту. При этом устанавливают содержание примесей. Их можно разделить на две группы: примеси, оказывающие влияние на фармакологическое действие лекарственного препарата, и примеси, указывающие на степень очистки вещества. Последние не влияют на фармакологический эффект, но присутствие их в больших количествах снижает концентрацию и соответственно уменьшает активность препарата. Поэтому фармакопеи устанавливают определенные пределы этих примесей в лекарственных препаратах.
Таким образом, основной критерий доброкачественности лекарственного препарата – наличие допустимых пределов фармакологически неактивных примесей и отсутствие токсичных примесей.
В ГФ ХI и XII приведены испытания на содержание 8 примесей: 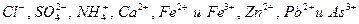 . Для оценки количества этих примесей применяют эталонные растворы (табл. 1).
. Для оценки количества этих примесей применяют эталонные растворы (табл. 1).
Общая методика приготовления эталонных растворов:
Стандартный раствор → эталонный раствор.
Навеску исходного вещества помещают в мерную колбу на 1 л и доводят водой очищенной до метки (стандартный раствор). С помощью мерной пипетки определенное количество стандартного раствора переносят в другую колбу и доводят объем до метки (эталонный раствор).
Требования, предъявляемые к веществам, из которых готовят эталонные растворы:
1. Данные вещества должны иметь маркировку х.ч. или ч.д.а.
2. Должны быть доведены до постоянной массы.
Общая методика определения допустимых пределов физиологически неактивных примесей.
Берут две пробирки. В одну из них помещают 10 мл исследуемого раствора, приготовленного по методике ФС, в другую – 10 мл эталонного раствора на соответствующую примесь. Одновременно в обе пробирки в равных количествах добавляют сначала неосновной реактив, затем основной. Перемешивают, сравнивают. Окраска или опалесценция в исследуемом растворе не должна превышать окраску или опалесценцию эталонного раствора.
| Таблица 1 – Определение основных примесей к лекарственным препаратам | |||||
| Наименование примеси | Исходное вещество для приготовления эталонного раствора | Неосновной реактив | Основной реактив | Химизм реакции | Результат |
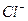
| 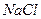
| 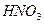
| 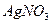
| AgNO3 + Cl- → AgCl + NO3- | белая опалесценция |
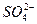
| 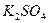
| 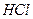
| 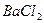
| BaCl2 + SO42- → BaSO4 + 2Cl- | белая опалесценция |
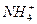
| 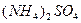
| 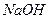
| K2[HgI4] | 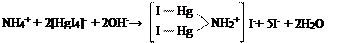
| желтое окрашивание |
| 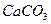
| 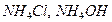
| (NH4)2C2O4 | Ca2+ + (NH4)2C2O4 → CaC2O4 + NH4+ | белая опалесценция |
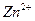
| 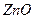
| 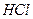
| K4[Fe(CN)6] | Zn2+ + K4[Fe(CN)6] → ZnK2[Fe(CN)6] + 2K+ | белая опалесценция |
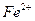 и и 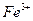
| 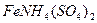
| 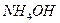
| 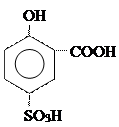
| 
| желтое окрашивание |
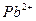
| 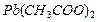
| 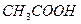
| Na2S | Pb2+ + Na2S → PbS + 2Na+ | черный осадок |
|
|
| I метод: 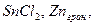 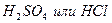
| HgCl2 | As2O3 + 6Zn + 12HCl → 2AsH3 + 6ZnCl2 + 3H2O 2AsH3 + 3HgCl2 → As2Hg3 + 6HCl | оранжево-желтое окрашивание |
II. метод: 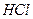
| NaH2PO2 | HCl + NaH2PO2 → H3PO2 + NaCl As2O3 + 3H3PO2 → 2As + 3H3PO3 | бурый осадок | ||
1. Испытание на хлориды.
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору.
Опалесценция, появившаяся в испытуемом растворе, не должна превышать эталон.
2. Испытание на сульфаты
Растворы сульфатов в зависимости от их концентрации образуют с растворами солей бария белый осадок или муть, не исчезающие от прибавления разведенной хлористоводородной кислоты.
Предельная чувствительность реакции 0,003 мг (3 мкг) сульфат-иона в 1 мл раствора. 0,01 мг (10 мкг) сульфат-иона в 1 мл раствора дает при этой реакции через 10 мин заметную муть.
Определение проводят следующим образом: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору.
Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
3. Испытание на соли аммония
МЕТОД I.
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,15 мл реактива Несслера, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактива, какое прибавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать эталон.
В препаратах, содержащих щелочноземельные и тяжелые металлы, определение проводят следующим образом: испытуемое вещество растворяют в возможно меньшем количестве воды, прибавляют при охлаждении 2 мл раствора едкого натра и 2 мл раствора карбоната натрия.
Раствор разбавляют водой до требуемой концентрации, взбалтывают и фильтруют. В 10 мл фильтрата проводят определение, как указано выше.
В препаратах, содержащих более 0,03% примеси железа, определение проводят следующим образом: к 10 мл раствора испытуемого препарата прибавляют. 2 капли раствора едкого натра и 3 мл 20% раствора тартрата натрия-калия. После тщательного перемешивания прибавляют 0,15 мл реактива Несслера и далее поступают, как указано выше.
МЕТОД II.
5 мл раствора испытуемого препарата, указанной в соответствующей частной статье концентрации, помещают в коническую колбу вместимостью 25 мл, прибавляют 5 мл раствора едкого натра. Сверху колбы помещают смоченную водой красную лакмусовую бумагу и закрывают часовым стеклом. Колбу ставят на водяную баню.
Наблюдение проводят через 5 мин.
4. Испытание на соли кальция
Определение кальция в неорганических соединениях.
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору.
Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
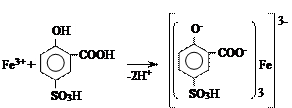
5. Определение железа в растворах лекарственных средств
МЕТОД 1.
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. 10 мл стандартного раствора железо (III)-иона (3 мкг/мл).
К испытуемому и стандартному растворам прибавляют по 2 мл 10 % раствора сульфосалициловой кислоты, 1 мл 10 % раствора аммиака, перемешивают и через 5 мин сравнивают окраску растворов.
Определение солей железа в соединениях магния.
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. 10 мл стандартного раствора железо (III)-иона (3 мкг/мл).
К испытуемому и стандартному растворам прибавляют по 2 мл 10 % раствора сульфосалициловой кислоты, 0,5 мл 10,7 % раствора аммония хлорида, 1 мл 10 % раствора аммиака и через 5 мин сравнивают окраску растворов.
Определение солей железа в соединениях алюминия
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. 10 мл стандартного раствора железо (III)-иона (3 мкг/мл). К испытуемому и стандартному растворам прибавляют по 5 мл 10 % раствора сульфосалициловой кислоты, 2 мл 10 % раствора натрия гидроксида и сравнивают окраску растворов.
МЕТОД 2.
Испытуемый раствор, 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. 10 мл стандартного раствора железо (III)-иона (1 мкг/мл).
К испытуемому и стандартному растворам прибавляют по 2 мл 20 % раствора лимонной кислоты и 0,1 мл тиогликолевой кислоты, перемешивают, добавляют раствор аммиака до щелочной реакции, разбавляют водой до 20 мл, перемешивают и через 5 мин сравнивают окраску растворов.
МЕТОД 3.
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. К 3 мл стандартного раствора железо (III)-иона (1 мкг/мл) прибавляют 7 мл воды.
К испытуемому и стандартному растворам прибавляют по 0,5 мл хлористоводородной кислоты концентрированной, 10 мг аммония персульфата и 1,5 мл 15 % раствора аммония тиоцианата, перемешивают и сравнивают окраску растворов.
6. Испытание на соли цинка
К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл хлористоводородной кислоты, 5 капель раствора ферроцианида калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
Примечание. В случае появления в испытуемом растворе синего окрашивания, мешающего нефелометрическому сравнению, следует предварительно отделить железо. Для этого к испытуемому раствору, нагретому до кипения; прибавляют раствор аммиака до отчетливого запаха и смесь фильтруют. В соответствующей части фильтрата определяют цинк.
7. Определение тяжелых металлов в растворах лекарственных средств.
Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в частной фармакопейной статье.
Эталонный раствор. К 2 мл стандартного раствора свинец-иона (5 мкг/мл) прибавляют 8 мл воды.
Контрольный раствор. 10 мл воды.
Примечание. Если при приготовлении испытуемого раствора используется органический растворитель, то эталонный, контрольный и стандартный растворы свинец-иона готовят с использованием того же растворителя.
Метод 1. К полученным растворам прибавляют по 1 мл уксусной кислоты разведенной 30 %, 2 капли 2 % раствора натрия сульфида, перемешивают и через 1 мин сравнивают окраску растворов.
В сравниваемых растворах допустима лишь слабая опалесценция от выделившейся серы.
Метод 2. К полученным растворам прибавляют по 2 мл ацетатного буферного раствора рН 3,5, перемешивают, прибавляют по 1 мл тиоацетамидного реактива, перемешивают и через 2 мин сравнивают окраску растворов.
8. Испытание на мышьяк
Если в фармакопейной статье нет специального указания, го испытание следует проводить по методу I.
МЕТОД I.
Метод I основан на переведении примесей мышьяка в мышьяковистый водород.
В колбу (рис 1), где находится соответствующим образом приготовленное вещество (см. ниже), прибавляют от 10 до 12 капель раствора дихлорида олова, 2 г гранулированного цинка (без мышьяка) и тотчас закрывают колбу пробкой со вставленной в нее верхней частью прибора. Содержимое колбы осторожно взбалтывают и оставляют на 1 ч. При этом температура реакционной смеси не должна превышать 40°С. Параллельно в другом таком же приборе проводят контрольный опыт со всеми реактивами и с прибавлением 0,5 мл эталонного раствора мышьяка. Через 1 ч полоску бумаги, пропитанную раствором дихлорида ртути, помещают в раствор йодида калия. Через 10 мин раствор йодида калия сливают, полоску бумаги тщательно промывают несколько раз водой декантацией в том же стакане и сушат между листами фильтровальной бумаги. Полоска бумаги, взятая из прибора с исследуемым веществом, не должна быть окрашенной или окраска ее не должна быть интенсивнее окраски полоски бумаги в контрольном опыте.
МЕТОД II.
Метод II основан на переведении примесей мышьяка в металлический мышьяк.
Метод II применяют в случае определения наряду с мышьяком селена и теллура, а также при определении мышьяка в препаратах сурьмы, висмута, ртути и серебра, препаратах, содержащих сульфиды и сульфиты, и в некоторых других случаях. Указания о применении метода II даются в соответствующих частных статьях.
Навеску вещества после предварительной обработки, описанной в соответствующей частной статье, вносят в пробирку, прибавляют 5 мл раствора гипофосфита натрия, помещают в пробирку в кипящую водяную баню и нагревают в течение 15 мин.

В испытуемой жидкости не должно быть заметно ни побурения, ни образования бурого осадка.
В случае побурения или образования бурого осадка в пробирку после охлаждения прибавляют 3 мл воды, 5 мл эфира и тщательно взбалтывают. При наличии мышьяка на границе жидкостей образуется бурая пленка.
Вопросы для самоконтроля:
1. Укажите основные пути получения лекарственных средств и перечислите источники появления примесей.
2. Приведите классификацию примесей.
3. Укажите, какие примеси могут встречаться в большинстве лекарственных средств и источники их появления?
4. Укажите внешние факторы, неблагоприятно влияющие на лекарственные средства при их хранении.
5. Приведите примеры типов химических реакций, внешних факторов, которые могут вызывать изменения внешнего вида лекарственных средств, их химического состава при несоблюдении правил хранения.
6. Каким образом внешний вид характеризует качество лекарственных веществ? Какие критерии при этом используются? Охарактеризуйте их субъективность или объективность.
7. Какие физические и физико-химические константы могут измениться при появлении примесей в лекарственных средствах?
8. Укажите, как готовятся эталонные растворы для определения примесей хлоридов, сульфатов и т.д. и сделайте вывод об общем принципе приготовления эталонных растворов для определения примеси.
9. Напишите уравнения реакций и укажите условия определения примесей хлоридов, сульфатов и т.д. в случае допустимой и недопустимой примеси и сделайте вывод об общем принципе определения допустимых и недопустимых примесей.
10. Какими критериями руководствуются при выборе реакций для определения различных примесей?
11. Почему при определении примеси железа используют сульфосалициловую кислоту?
12. Почему регламентируется время реакций?
13. Почему при определении примеси тяжёлых металлов производят определение окраски по оси пробирок?
14. Почему при определении тяжелых металлов в сульфатной золе органических препаратов зольный остаток обрабатывают насыщенным раствором аммония ацетата?
15. В каких случаях применяют I и II методы испытания на мышьяк?
16. Изобразите прибор при испытании на мышьяк по методу I.
17. В чем заключается подготовка препаратов для определения в них мышьяка по методу I?
18. Какова роль раствора олова дихлорида; гранулированного цинка; ваты, пропитанной раствором свинца ацетата; полоски бумаги, пропитанной раствором ртути (II) хлорида?
19. Каким образом проводится испытание примеси мышьяка по методу II?
ЗАНЯТИЕ № 3. Растворимость, прозрачность и цветность раствора, кислотность и щелочность, определение сульфатной золы, потери в массе при высушивании, определение летучих веществ и воды.
Растворимость – свойство газообразных, жидких и твердых веществ переходить в растворенное состояние. Растворимость в фармакопейном анализе рассматривают как свойство ЛВ растворяться в различных растворителях, принятых ГФ. Растворимость при постоянной температуре является одной из основных характеристик, с помощью которой подтверждают доброкачественность большинства ЛВ.
Для обозначения растворимости в ГФ XII приняты условные термины, указывающие количество растворителя (мл), необходимое для растворения 1 г ЛВ.
| Условный термин | Количество растворителя (мл), необходимое для растворения 1 г препарата |
| Очень легко растворим | менее 1 |
| Легко растворим | от 1 до 10 |
| Растворим | от 10 до 30 |
| Умеренно растворим | от 30 до 100 |
| Мало растворим | от 100 до 1000 |
| Очень мало растворим | от 1000 до 10000 |
| Практически нерастворим | более 10000 |
Для субстанций с неизвестной растворимостью испытание проводят по следующей методике.
К 1,00 г растертой субстанции прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если субстанция полностью растворилась, она очень легко растворима.
Если субстанция растворилась не полностью, к 100 мг растертой субстанции прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если субстанция полностью растворилась, она легко растворима.
Если субстанция растворилась не полностью, добавляют 2,0 мл растворителя и продолжают растворение. Если субстанция полностью растворилась, она растворима.
Если субстанция растворилась не полностью, добавляют 7,0 мл растворителя и продолжают растворение. Если субстанция полностью растворилась, она умеренно растворима.
Если субстанция растворилась не полностью, к 10 мг растертой субстанции прибавляют 10,0 мл растворителя и проводят растворение, как описано выше. Если субстанция полностью растворилась, она мало растворима.
Если субстанция растворилась не полностью, к 10 мг растертой субстанции прибавляют 100 мл растворителя и проводят растворение, как описано выше. Если субстанция полностью растворилась, она очень мало растворима.
Если субстанция не растворилась, она практически нерастворима в данном растворителе.
Для субстанций с известной растворимостью испытание проводят по описанной выше методике, но только для крайних значений, относящихся к указанному термину. Например, если субстанция растворима, то 100 мг растертой субстанции не должны растворяться в 1,0 мл растворителя, но должны раствориться полностью в 3,0 мл растворителя.
Отклонения от этого общего правила:
1. Для крупнокристаллических веществ допускается измельчение в ступке.
2. Для медленно растворимых веществ допускается нагревание на водяной бане не выше 30 оС.
3. Допускается уменьшение первичной навески исследуемого вещества, если для его растворения требуется большое количество растворителя.
В качестве растворителей, кроме воды, используются растворы кислот и щелочей (карбонатов), а также различные органические растворители (этанол, метанол, хлороформ, эфир, ацетон, гексан, дихлорэтан, этилацетат) и масла.
 2020-09-24
2020-09-24 662
662