Раствор называется прозрачным, если невооруженным глазом на черном фоне при освещении лампой в 40Вт не видны нерастворившиеся частицы, кроме единичных волокон.
Определение прозрачности и степени мутности жидкостей.
Прозрачность и степень мутности жидкостей определяют путем сравнения испытуемой жидкости с растворителем, если раствор должен быть прозрачным, или эталонами, если раствор мутный. Сравнение проводят с растворителем, взятым для приготовления жидкостей.
Схема приготовления эталонных растворов на мутность:
Исходный эталон → Основной эталон → Эталон сравнения.
Исходный эталон получают путем смешения равных объемов растворов гексаметилентетрамина (уротропина, метамина) и гидразина сульфата. Затем определенное количество исходного эталона переносят в мерную колбу и доводят водой очищенной до метки (основной эталон). Из основного эталона готовят 4 эталона сравнения:
| № эталона Компоненты срав-я | I | II | III | IV |
| Основной раствор, мл | 5 | 10 | 30 | 50 |
| Н2О, мл | 95 | 90 | 70 | 50 |
Эталоны сравнения I, II, III, IV должны быть свежеприготовленными.
Методика определения степени мутности:
Для сравнения берут равные объемы эталонного раствора и испытуемой жидкости (5 или 10 мл). Сравнение проводят в пробирках бесцветного стекла или стекла одинакового оттенка, одного и того же диаметра с притертыми пробками. Степень мутности исследуемого раствора не должна превышать эталон.
Определение степени мутности окрашенных жидкостей производят в компараторе (рис. 2). Часть испытуемой жидкости фильтруют через бумажный фильтр; в компараторе помещают рядом пробирки с фильтрованной и нефильтрованной жидкостями; позади пробирки с нефильтрованной жидкостью ставят пробирку с растворителем, позади пробирки с фильтрованной жидкостью помещают последовательно пробирки с соответствующими эталонами мутности до появления мути, сходной с мутью нефильтрованной жидкости. Пробирки просматривают при подсвечивании электрической лампой 40Вт.
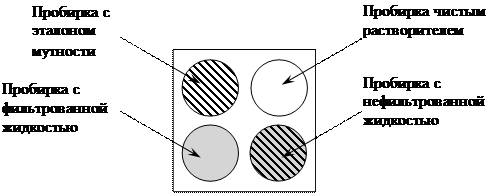
Рисунок 2. Схема компаратора.
Цветность растворов.
Окраску жидкостей определяют с помощью визуального сравнения с эталонами. Исследуемые жидкости и эталоны берут для сравнения в равных количествах. Бесцветными считают жидкости, которые по цвету не отличаются от воды, а в случае растворов – от соответствующего растворителя.
Для визуальной оценки окраски жидкостей в зависимости от интенсивности в области коричневых, желтых и красных цветов используют один из двух методов, описанных в статье.
Метод 1.
Испытания проводят в одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром около 12 мм, используя равные объемы – 2,0 мл испытуемой жидкости и воды, или растворителя, или эталона сравнения, описанного в статье. Сравнивают окраску в дневном отраженном свете, горизонтально (перпендикулярно оси пробирок) на матово-белом фоне (эталоны 1 – 3).
Метод 2.
Испытания проводят в одинаковых пробирках из бесцветного, прозрачного, нейтрального стекла с внутренним диаметром от 15 до 25 мм, используя равные слои высотой 40 мм испытуемой жидкости и воды, или растворителя, или эталона сравнения, описанного в статье. Сравнивают окраску в дневном отраженном свете сверху вдоль вертикальной оси пробирок на матово-белом фоне (эталоны 4 – 9).
Эталоны для определения степени окраски жидкостей по методу I хранят в ампулах из бесцветного прозрачного нейтрального стекла с наружным диаметром 12 мм, в защищенном от света месте в течение 1 года.
Эталоны, используемые для определения степени окраски жидкостей по методу II, готовят из соответствующих стандартных растворов непосредственно перед использованием.
Для определения окраски жидкостей существует 37 эталонных растворов:
- 9 эталонов коричневых оттенков (шкала В);
- 7 эталонов коричневато-желтых оттенков (шкала BY);
- 7 эталонов желтых оттенков (шкала Y);
- 7 эталонов зеленовато-желтых оттенков (шкала GY);
- 7 эталонов красных оттенков (шкала R).
Их получают следующим путем: исходный раствор → стандартный раствор → эталонный раствор.
Приготовление исходных растворов.
1. Желтый раствор готовят из железа (III) хлорида (FeCl3·6H2O).
2. Красный раствор готовят из кобальта хлорида (CoCl2·6H2O).
3. Синий раствор готовят из меди (II) сульфата (CuSO4·5H2O).
Данные растворы готовят путем растворения навески соответствующей соли в 1% кислоте хлористоводородной.
Стандартные растворы готовят путем смешения 3 исходных растворов между собой.
Эталонные растворы для сравнения приготавливают из основных растворов путем разбавления их 1% кислотой хлористоводородной в различных соотношениях.
Степень окраски испытуемого раствора не должна превышать степень окраски соответствующего эталона. Цвет испытуемого образца должен быть максимально приближен к цвету соответствующего эталона.
При сравнении окраски испытуемого раствора с эталонами указывают, кроме номера эталона, букву шкалы. Например, окраска раствора не должна превышать эталон В7.
При необходимости могут быть использованы другие эталоны, приготовленные путем смешения стандартных растворов разных цветовых шкал с точным указанием их объемов для достижения нужной окраски, приближенной к окраске испытуемого раствора, если это предусмотрено частной статьей.
Для оценки окраски жидкостей возможно использование спектрофотометрического метода, при этом должны быть указаны: длина волны, при которой наблюдается максимум поглощения в видимой области спектра, толщина кюветы и значение оптической плотности с допустимыми отклонениями, если это предусмотрено частной фармакопейной статьей.
Определение рН.
Важную информацию о степени чистоты лекарственного препарата дает значение рН его раствора. По этому значению можно судить о наличии примесей кислых или щелочных продуктов.
Принцип обнаружения примесей свободных кислот (неорганических и органических), свободных щелочей, т.е. кислотности и щелочности, заключается в нейтрализации этих веществ в растворе препарата или в водном экстракте. Нейтрализацию выполняют в присутствии индикаторов, (фенолфталеин, метиловый красный, тимолфталеин, бромфеноловый синий и др.). О кислотности или щелочности судят либо по окраске индикатора, либо по ее изменению, либо устанавливают количество титрованного раствора щелочи или кислоты, затраченное на нейтрализацию.
Степень кислотности или основности растворов необходимо учитывать при выполнении испытаний чистоты лекарственных препаратов и количественного определения. От значений рН растворов зависят сроки хранения лекарственных веществ, а также особенности их применения.
Значение рН ориентировочно (до 0,3 ед.) можно определять с помощью индикаторной бумаги или универсального индикатора. Из многочисленных способов установления значения рН среды ГФ XI рекомендует колориметрический и потенциометрический способы.
Колориметрический способ основан на свойстве индикаторов изменять свою окраску при определенных интервалах значений рН среды. Для выполнения испытаний используют буферные растворы с постоянной концентрацией водородных ионов, отличающихся друг от друга на величину рН, равную 0,2. К серии таких растворов и к испытуемому раствору прибавляют одинаковое количество (2 – 3 капли) индикатора. По совпадению окраски с одним из буферных растворов судят о значении рН среды испытуемого раствора.
В качестве реактивов для приготовления стандартных буферных растворов используют сочетания различных соотношений растворов хлорида калия, гидрофталата калия, однозамещенного фосфата калия, борной кислоты, тетрабората натрия с хлористоводородной кислотой или раствором гидроксида натрия. Вода очищенная, используемая для приготовления буферных растворов, должна иметь рН 5,8 – 7,0 и быть свободной от примеси углекислого газа.
Потенциометрическое определение рН основано на измерении электродвижущей силы элемента, составленного из стандартного электрода (с известным значением потенциала) и индикаторого электрода, потенциал которого зависит от рН испытуемого раствора. Потенциометрический способ определения рН отличается от колориметрического более высокой точностью. Он имеет меньше ограничений, может быть применен для определения рН в окрашенных растворах, а также в присутствии окислителей и восстановителей.
Определение золы.
Для установления чистоты лекарственных препаратов широко используют определение золы.
Зола – это остаток после сжигания лекарственного препарата.
Прокаливанием навески препарата в фарфоровом (платиновом) тигле устанавливают общую золу. Затем после добавления разведенной хлористоводородной кислоты определяют золу, нерастворимую в хлористоводородной кислоте. Кроме того, определяют также сульфатную золу, получаемую после нагревания и прокаливания навески препарата, обработанной концентрированной серной кислотой. Общую золу и золу, нерастворимую в хлористоводородной кислоте устанавливают только в лекарственном растительном сырье (ЛРС). Определение сульфатной золы сочетают с определением примеси тяжелых металлов в зольном остатке.
 2020-09-24
2020-09-24 2123
2123








