Чистую бюретку наполняют дистиллированной водой до нулевой отметки. Выпускают из бюретки 100 капель и замечают на бюретке объём, отсчёт которого производят не ранее чем через 30 с после выливания воды. Полученный объём делят на 100. Операцию повторяют не менее трёх раз, каждый раз вычисляя объём капли с точностью до 0,01 мл. Расхождение между тремя измерениями не должно превышать 0,01 мл. Для чего необходимо знать объём капли из бюретки?
Стандартизация раствора гидроксида натрия по соляной кислоте.
Стандартизацию раствора гидроксида натрия по соляной кислоте можно проводить в присутствии метилового оранжевого или с фенолфталеином. В данном случае рН в точке эквивалентности 7, поэтому титрование в присутствии указанных выше индикаторов будет или перетитрован или недотитрован.
I. Титрование в присутствии метилового оранжевого.
1.В бюретку наливают 0,1 н раствор гидроксида натрия и закрывают бюретку трубкой с натронной известью. С какой целью это делают?
2.В колбу для титрования на 100,00 мл отмеряют 25,00 мл раствора соляной кислоты, добавляют 1 каплю метилового оранжевого и титруют раствором гидроксида натрия до изменения окраски раствора из красной через оранжевую в жёлтую.
3.Титруют не менее 3-ёх раз, результаты всех титрований не должны отличаться на 0,01 мл.
Сделать соответствующие расчёты (для расчета используют средний объём щёлочи):
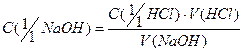
II. Титрование в присутствии фенолфталеина.
Титрование проводят аналогично титрованию в присутствии метилового оранжевого и титруют раствором гидроксида натрия до бледно-розовой окраски, устойчивой в течение 30 с. Необходимо помнить, что титровать по возможности необходимо быстро, раствор не следует интенсивно перемешивать во избежание поглощения раствором СО2 из воздуха.
Сделать соответствующие расчёты и выводы.
Ый курс Лечебное дело
Задание №5-6. Перманганатометрия.
Приготовление и установка титра раствора перманганата калия по щавелевой кислоте. Определение массы пероксида водорода в растворе.
В сильнокислой среде перманганат-ионы обладают высоким окислительно-восстановительным потенциалом, восстанавливаясь до Mn2+:
MnO4- + 8H+ + 5ē ↔ Mn2+ + 4H2O E0 MnO4- /Mn2+=1,51 В.
Перманганатометрическое титрование применяют для количественного определения восстановителей, таких, как Н2О2, MgO2, NaNO2, FeSO4, металлического железа, карбоновых кислот и ряда других соединений. При данном виде титрования не используют индикатор, так как титрант сам окрашен и точку эквивалентности определяют по появлению едва заметной бледно-розовой окраски раствора после добавления последней капли титранта.
Титрант следует хранить в темном месте, так как свет ускоряет разложение перманганата калия:
4KMnO4 + 2H2O = 4MnO2↓ + 4KOH + 3O2↑.
Установка титра раствора перманганата калия производят по щавелевой кислоте Н2С2О4·2Н2О или оксалату натрия (Na2С2О4) или калия.
5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+ K2SO4+8H2O.
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O
H2C2O4+2ē → 2CO2+2Н+.
Титрование перманганатом калия проводят без индикатора.
Ход работы.
 2020-09-28
2020-09-28 277
277








