1. Давление пара над раствором (I закон Рауля)
давление над раствором нелетучего растворенного вещества (Pi) всегда меньше, чем над растворителем при той же температуре (Pi0), или
Pi = Pi0 ×nмоль, где nмоль – мольная доля растворенного вещества
2. Температура кипения и замерзания раствора (II закон Рауля)
Ткип раствора выше, чем температура кипения чистого растворителя. Повышение температуры кипения прямо пропорционально моляльности растворенного вещества (Е – эбулиоскопическая постоянная растворителя)
DTкип = i E× m
Ткрист раствора ниже, чем температура кристаллизации чистого растворителя. Понижение температуры кристаллизации прямо пропорционально моляльности растворенного вещества (К – криоскопическая постоянная растворителя)
DTкрист = i K× m
i – изотонический коэффициент, определяющий количество частиц, образующихся в растворе при растворении вещества:
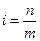 ,
,
где n – общее число частиц в растворе, m – число частиц, подвергшихся растворению. Для неэлектролита i = 1; для электролита i > 1; для коллоидных систем i < 1.
В растворах электролитов изотонический коэффициент связан со степенью диссоциации α:
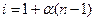
NaCl → Na+ + Cl– n = 2, α = 1, i =2
K2SO4 → 2K+ + SO42– n = 3, α = 1, i =3
3. Осмотическое давление (закон Вант-Гоффа)
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество при данной температуре, находясь в виде газа в объеме раствора.
Росм = i СМ×R×T
Осмос – процесс односторонней диффузии растворителя через полупроницаемую мембрану по градиенту концентрации растворенного вещества.
Осмотическое давление – равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану.
Теория электролитической диссоциации
Основные понятия
Электролит – вещество, при растворении которого образуются ионы. К электролитам относятся кислоты, основания и соли.
Na2SO4 ® 2Na+ + SO42-
Теория Аррениуса
- Электролиты при растворении распадаются на ионы.
- Ионизация (диссоциация) происходит в той или иной степени (иногда не полностью); α – степень диссоциации (доля продиссоциировавших молекул):
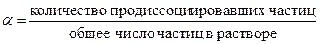
Сильные электролиты – вещества, которые практически полностью диссоциируют в растворе; α близка к 1 (от 70 до 100%).
Слабые электролиты – в растворе диссоциируют лишь в малой степени; α близка к 0 (от 10% и меньше).
 2020-09-24
2020-09-24 116
116








