Раствор – сложная равновесная гомогенная химическая система, состоящая из растворителя, растворенных веществ и продуктов их взаимодействия.
Растворитель – вещество, которое в чистом виде находится в такой же фазе, что и раствор, а в растворе присутствует в наибольшем количестве.
Растворимость – максимальная масса вещества, способная раствориться в 100 г растворителя при определенной температуре или молярная концентрация насыщенного раствора.
По агрегатному состоянию растворы делятся на:
- газообразные (например, воздух)
- жидкие (растворы газов воде, растворы твердых веществ в жидкости, смеси жидкостей)
- твердые (сплав металлов, растворы газов в твердом веществе)
По содержанию растворенных вешеств растворы делятся на
- разбавленные (низкое содержание растворенного вещества)
- концентрированные (высокое содержание растворенного вещества)
По содержанию вещества относительно его растворимости растворы делятся на:
- насыщенные (достигнута растворимость, больше при данной температуре вещество раствориться не может); DG = 0
- ненасыщенные (при данной температуре можно еще растворить вещество); DG < 0
- пересыщенные (содержание вещества превышает растворимоть при данной температуре); DG > 0
Способы выражения концентраций растворов
Доли (0 £ n £ 1): содержание растворенного вещества в 1 кг (массовая) или в 1 л (объемная) или 1 моле (мольная) раствора
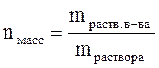
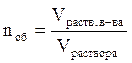
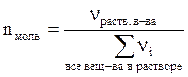
Процентные (0%£w£100%): содержание растворенного вещества в 100 г (массовая) или 100 мл (объемная) раствора в процентах
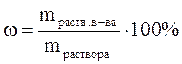
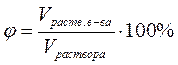
Молярная концентрация См или М (молярность) – число моль растворенного вещества в 1 литре раствора (моль/л).
Нормальная концентрация СN или н (нормальность) – число эквивалентов растворенного вещества в 1 литре раствора (экв/л).
Моляльная концентрация m (моляльность) – число моль растворенного вещества в 1 кг растворителя (моль/кг).
 2020-09-24
2020-09-24 102
102








