Тема 1. Основы химической термодинамики. Термохимия.
1. Химическая термодинамика как наука. Первый закон термодинамики, его формулировка и математическое выражение.
Вычислить тепловой эффект реакции 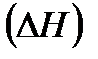 при стандартных условиях
при стандартных условиях 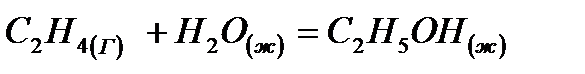
2. Что такое термодинамическая система? Гомо- и гетерогенные системы. Открытые, закрытые и изолированные системы.
Вычислить тепловой эффект реакции 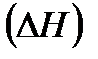 при стандартных условиях
при стандартных условиях 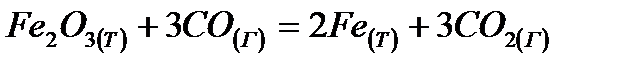
3. Параметры термодинамической системы. Понятия об изобарных, изотермических и изохорных процессах.
Вычислить тепловой эффект реакции 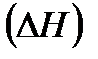 при стандартных условия
при стандартных условия 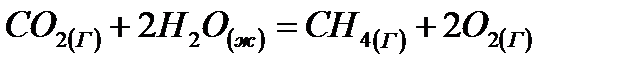
4. Что называется внутренней энергией системы? Можно ли определить абсолютную величину внутренней энергии?
Вычислить тепловой эффект реакции 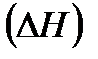 при стандартных условиях
при стандартных условиях 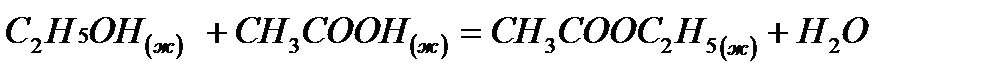
5. Понятие об энтальпии. Закон Гесса и следствия из него.
Вычислить тепловой эффект реакции 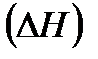 при стандартных условиях
при стандартных условиях 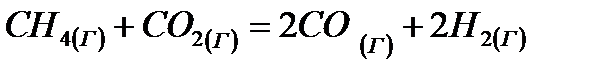
6. Термохимические реакции. Определение теплоты реакции по методике Гесса. Калорийность продуктов питания.
Вычислить тепловой эффект реакции 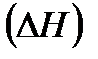 при стандартных условиях
при стандартных условиях
Аl203 (кр) + 3S03 = А12(SО4)3(кр)
7. Второй закон термодинамики. Его формулировки и расшифровка на примере работы тепловой машины.
Вычислить тепловой эффект реакции 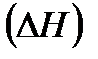 при стандартных условиях
при стандартных условиях
СН4(г) + 2О2(г) = С02(г) + 2Н20(г)
8. Понятие энтропии. Как по изменению энтропии в изолированной системе определить состояние равновесия?
Вычислить тепловой эффект реакции 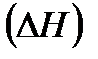 при стандартных условиях
при стандартных условиях
СО(г) + 1/2 02(г) = СО2(г)
9. Что такое необратимый термодинамический процесс? Приведите примеры таких процессов.
Вычислить тепловой эффект реакции 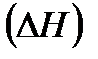 при стандартных условиях
при стандартных условиях
СаС03 = СаО + С02,
10. Что такое обратимый термодинамический процесс? Приведите примеры таких процессов.
Вычислить тепловой эффект реакции 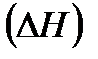 при стандартных условиях
при стандартных условиях
С2Н2 (г) +2,5 О2 = 2СО2 + Н20 (г)
Тема 2. Химическая кинетика и равновесие.
11. Химическое равновесие. Обратимые и необратимые реакции.
Как изменится скорость реакции 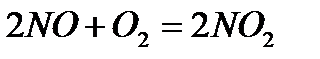 , если уменьшить объем сосуда в 3 раза?
, если уменьшить объем сосуда в 3 раза?
12. Скорость химической реакции, факторы на нее влияющие.
В какую сторону сместится химическое равновесие системы 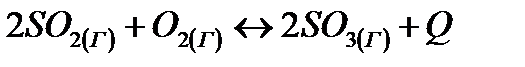
– при повышении температуры;
– при повышении давления;
– при увеличении концентрации оксида серы (VI)? Дайте обоснованный ответ.
13. Влияние концентрации на скорость химической реакции. Закон действующих масс.
Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на химическое равновесие системы:
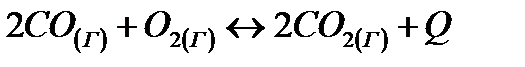
Дайте обоснованный ответ.
14. Влияние температуры на скорость химических реакций.
Укажите три условия, которые будут способствовать смещению химического равновесия реакции 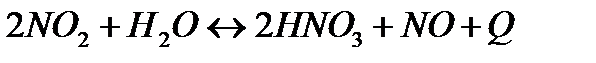 в сторону образования азотной кислоты.
в сторону образования азотной кислоты.
15. Катализ и катализаторы.
Дано уравнение обратимой химической реакции:
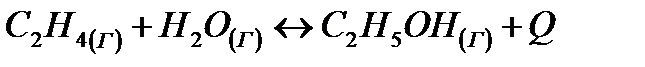
Укажите условия, которые вызывают смещение химического равновесия в сторону реакции образования этилового спирта. Дайте обоснованный ответ.
16. Смещение химического равновесия. Принцип Ле – Шателье.
Определите, во сколько раз увеличится скорость реакции 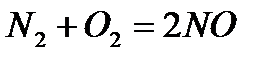 , если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме.
, если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме.
17. Количественная характеристика химического равновесия.
Во сколько раз увеличится скорость реакции при повышении температуры от 200 С до 700С, если температурный коэффициент равен 3?
18. Влияние температуры на смещение химического равновесия.
Реакция протекает по схеме: 2А+2В3=С. Начальная концентрация вещества А 5 моль/л, а вещества В3 6,8 моль/л. Константа скорости составляет 0,2. Определить скорость реакции.
19. Влияние давления на смещение химического равновесия.
При температуре 400 С реакция протекает 13 минут. Температурный коэффициент реакции равен 3. Сколько времени эта реакция будет протекать при температуре 600 С?
20. Влияние природы реагирующих веществ на скорость химических реакций. Дано уравнение обратимой химической реакции: 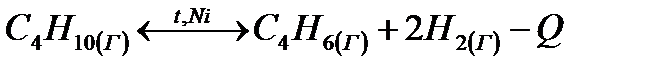
В какую сторону будет смещаться химическое равновесие данной реакции при: а) понижении температуры; б) уменьшении давления; в) уменьшении концентрации водорода? Дайте обоснованный ответ.
Тема 3. Растворы.
21. Рассчитать молярность раствора глюкозы, если массовая доля глюкозы 1%. Плотность раствора равна 1 г/см3.
22. Определить нормальность раствора азотной кислоты, если массовая доля НNО3 30%. Плотность раствора 1,224 г/см3.
23. Столовый уксус представляет собой 6%-ный водный раствор уксусной кислоты. Рассчитать, сколько граммов кислоты содержится в 120 г столового уксуса.
24. Сколько грамм Na2SO3 необходимо для приготовления 5 л 8 %-го раствора (ρ = 1,075 г/мл).
25. Определить процентную концентрацию 8 М раствора соляной кислоты, плотность которого 1,23 г/см3.
26. Определить массовую долю нитрата кальция в растворе, который получили смешиванием 200г 10%-го и 600г 20%-го растворов нитрата кальция.
27. Найти массу NаNО2, которая необходима для приготовления 300 см3 0,2М раствора NаNО2.
28. Какой объем 2М раствора Nа2СО3 необходимо взять для приготовления 1 л 0,25 н раствора?
29. В каком объеме 1М раствора и в каком объеме 1 н раствора содержится 114г Аl2(SО4)3?
30. Определить молярную концентрацию раствора серной кислоты, если нормальная концентрация равна 2.
Тема 4. Коллоидно-дисперсные системы. Растворы высокомолекулярных соединений. Студни.
31. Общая характеристика дисперсных систем. Классификация дисперсных систем. Приведите примеры дисперсных систем.
32. Коллоидные системы, их строение, основные свойства.
33. Эмульсии. Структура, классификация, методы получения, основные характеристики эмульсий, эмульгаторы. Эмульсии в пищевой промышленности.
34. Пены. Структура, методы получения, основные характеристики пен, пенообразователи. Пены в пищевой промышленности.
35. Суспензии. Структура, классификация, методы получения, основные характеристики суспензий. Суспезии в пищевой промышленности.
36. Аэрозоли. Структура, классификация, методы получения, основные характеристики аэрозолей. Аэрозоли в пищевой промышленности.
37. Порошки. Структура, методы получения, основные характеристики порошков. Порошки в пищевой промышленности.
38. Общие сведения о высокомолекулярных соединениях.
39. Свойства растворов высокомолекулярных веществ.
40. Студни. Получение студней. Свойства студней: диффузия, тиксотропия, синерезис.
Тема 5. Основы качественного анализа.
41. Как проверить раствор, содержащий катион аммония NH4+ на присутствие катиона натрия? Ответ подтвердите уравнениями реакций.
42.Какой реактив используется для подавления реакции гидролиза
групповых реактивов II и III групп карбоната аммония и сульфида аммония? Ответ подтвердите уравнениями реакций.
43.Какие свойства карбонат-иона CO2-3 используются при отделении его от сульфат - аниона?
44. Какова реакция среды (рН = 7; рН >7; рН < 7) в растворах солей:
a) (CH3COO)2Ba
б) NaCI
в) NH4CNS
45. Катионы К+входят в состав молока. С помощью каких реакций можно обнаружить катионы К+? Приведите соответствующие уравнения реакций.
46. При разложении белков мяса и рыбы (гниении) образуется аммиак. С помощью какого реактива можно быстро обнаружить присутствие катионов NH4? Составьте соответствующее уравнение реакции. Что наблюдается в результате реакции?
47. Реакция осаждения катионов Са2+ оксалатом аммония используется для
определения полноты вложения молока в молочных супах. Составьте соответствующие уравнение реакции. В чем растворяется и не растворяется образующийся осадок?
48. Как отделить катионы Fe3+ от катионов Сг3+? Ответ подтвердите уравнениями реакций.
49. При глубоком гнилостном распаде белков мяса и рыбы образуются летучие соединения, одним из которых является сероводород. Определить присутствие сероводорода можно с помощью раствора ацетата свинца. Составьте соответствующее уравнение реакции, опишите условия проведения реакции. Что наблюдается в результате реакции?
50. Кислоты разлагают все сульфиты с выделением диоксида серы SO2. Выделяющийся SO2 взаимодействует с раствором KМnO4. Реакция используется для определения общего количества SO2 в сыром очищенном сульфитированном картофеле. Составьте уравнения соответствующих реакций. Что наблюдается в результате реакций?
Тема 6. Основы гравиметрического (весового) анализа.
51. Сущность гравиметрического метода анализа. Операции гравиметрического метода анализа. Вычисления в гравиметрическом методе.
52. При определении гигроскопической воды в образце хлорида натрия (поваренной соли) получены следующие результаты: масса тигля – 7, 2393 г, масса тигля с навеской до прокаливания – 7,8809 г, после прокаливания – 7,8616г. Определить массовую долю воды в образце.
53. Навеска сахара, массой 2,6248 г после высушивания до постоянной массы стала весить 2,5420 г. Определите массовую долю влаги в образце.
54. Определите влажность муки в образце, если до высушивания его масса была – 3,4589 г, а после высушивания – 2,9747 г.
55. Определите навеску молотого кофе до высушивания, если после удаления
влаги масса стала 2,7852 г. Влажность данного образца молотого кофе составляет 3,8 %.
56. Сахар-песок массой 100 кг, который хранился на складе, поглотил влагу массой 14 кг. Сделайте вывод, можно ли сахар реализовывать, если стандарт предполагает массовую долю влаги не более 0,14 %.
57. Для печенья, изготовленного из муки высшего сорта, стандартом предусмотрено содержание влаги от 3 до 8,5 %. Сделайте вывод про качество печенья, если навеска образца была 9,9725 г, а после высушивания стала 8,5110 г.
58. Рассчитать влажность пшеничной муки первого сорта, если навеска образца массой 9,7651 г после высушивания и взвешивания стала 8,0020г. Стандартом предусмотрено содержание влаги не более 15 %. Сделайте вывод, отвечает ли образец стандарту?
59. При анализе некоторого продукта были получены следующие результаты:
мука - 87,56 %; Н20 - 11,30 %; NaCl - 1,14 %. Пересчитать полученные данные на абсолютно сухое вещество.
60. В результате анализа сплава железа получена весовая форма оксида железа (III) массой 0,1652 г. Определить массовую долю железа в исходном сплаве, если навеска его составляла 1,2140 г.
Тема 7. Основы титриметрического (объемного) анализа.
61. Кислотность является одним из показателей качества полуфабрикатов из
муки, творога, соков, сиропов и характеризует степень их свежести. На титрование 50,00 мл пробы сока израсходовали 20,00 мл 0,1 н. раствора щёлочи.
Определите нормальную концентрацию кислоты в пробе и титр раствора NaOH по НCI.
62. Для определения содержания поваренной соли в продукте, фильтрат вытяжки из творожных полуфабрикатов титрируют раствором азотнокислого серебра, титр которого равен 0,0292 г/мл. Определите нормальную концентрацию раствора AgNO3 и содержание AgNO3 в 250,00 мл раствора.
63. К фильтрату вытяжки из творога, объемом 50,00 мл добавили 2-3 капли 1% - го спиртового раствора фенолфталеина и титровали 0,1 н. раствором щёлочи до слаборозового окрашивания. На титрование израсходовано 15,00 мл раствора NaOH. Определите нормальную концентрацию кислоты в фильтрате вытяжки и титр раствора NaOH.
64. Что называется эквивалентом? Является ли эквивалентная масса одного и того же вещества в различных реакциях величиной постоянной? Рассчитайте эквивалентные массы H2SO4 в реакциях:
а) H2SO4 + 2 NaOH = Na2SO4 + 2Н2О
б) H2SO4 + NaOH = NaНSO4 + 2Н2О
65. Витамин С (аскорбиновая кислота С6Н8О6) определяют иодометрическим методом. Реакция идет по уравнению: С6Н8О6 + I2= С6Н6О6+2HI в присутствии крахмала в качестве индикатора. На титрование 5,00 мл пробы раствора витамина С израсходован 1,00 мл 0,1н. раствора I2. Определите нормальную концентрацию аскорбиновой кислоты в пробе и титр раствора йода I2.
66. На титрование раствора NaCI расходуется 30,20 мл раствора AgNO3 (Т AgNO3=0,1245г/мл). Определите массу NaCI в растворе. Составьте уравнения реакций, которые происходят при титровании.
67. На нейтрализацию 40,00 мл раствора серной кислоты израсходовано 24,00 мл 0,2 н. раствора щелочи NaOH. Какое количество H2SO4 содержится во взятом объеме раствора?
68. Чему равна общая жесткость воды, если на титрование 100,00 мл её израсходовали 12,15 мл 0,1022н. раствора трилона Б (ЭДТА). Является ли эта вода жесткой или мягкой?
69. Определите эквивалентные массы окислителя и восстановителя и решите уравнения окислительно-восстановительных реакций:
Cr2(SO4)3 + КОН + H2O2 = К2СгO4 + Н2О
KМnO4 + Na2S2O3 + H2SO4=Na2SO4 + MnSO4 + K2SO4+H2O
70. Какой объем раствора азотной кислоты потребуется для нейтрализации КOH массой 0,28г, если Т(НNО3) = 0,001260 г/мл.
Тема 8. Белки. Жиры. Углеводы.
71. Охарактеризуйте первичную структуру белков. Покажите связи, обеспечивающие стабильность этой структуры и механизм их образования.
72. Как доказать, что в составе молока есть белок и лактоза, имея в распоряжении только щелочь и раствор сульфата меди.
73. Какие амины могут образоваться при гнилостном разложении белков? Приведите формулы этих аминов и укажите их действие на организм человека.
74. Какие амины образуются при созревании сыров? Приведите их формулы. Можно ли обнаружить эти амины с помощью индикатора? Ответ пояснить уравнениями соответствующих реакций.
75. Какие аминокислоты называют незаменимыми? Приведите формулу незаменимой аминокислоты лейцин и объясните, почему ее раствор не дает реакции на индикаторы.
76. Биологическая ценность белков. Полноценные и неполноценные белки. Приведите три примера аминокислот, определяющих полноценность белка.
77. Чем отличаются по составу простые и сложные белки? Какими цветными реакциями можно обнаружить белки в составе пищевых продуктов?
78. Чем отличаются по составу твердые жиры от масел? Напишите уравнения реакций получения жира, образованного глицерином со следующими кислотами: а) тремя молекулами пальмитиновой кислоты; б) стеариновой,
пальмитиновой, олеиновой. Назовите полученные триглицериды.
79. В составе льняного масла встречается глицерид дилинолеолинолеин. Напишите формулу этого глицерида и определите его йодное число.
80. На нейтрализацию кислот в 10 г жира пошло 0,56 г щелочи КОН. Определите кислотное число данного жира и укажите значение этого показателя при оценке качества пищевых жиров.
81. В составе подсолнечного масла преобладает диолеолинолен, в составе льняного – линолеодилинолеин. Какое масло будет иметь более высокое йодное число? Ответ подтвердите расчетами.
82. В состав подсолнечного масла входит диолеолинолен. Составьте уравнение реакции его гидрогенизации и укажите использование гидрогенизированного жира в производстве пищевых продуктов.
83. Напишите формулы триглицеридов: а) диолеостеарина, б) олеолинолеолинолеина. Вычислите йодное число одного из них и укажите значение этого показателя при оценке качества пищевых жиров.
84. Составьте уравнение реакции спиртового брожения глюкозы и рассчитайте, сколько глюкозы подверглось брожению, если выделившийся углекислый газ при нормальных условиях занял объем 112 л. В производстве каких пищевых продуктов имеет место спиртовое брожение?
85. Составьте схему ступенчатого гидролиза крахмала и уравнение реакции гидролиза. Укажите условия реакции и ее практическое значение.
86. Как получают и для каких целей используют инвертный сахар? Сколько кг инвертного сахара можно получить из 17, 1 кг сахарозы?
87. Составьте уравнения реакций следующих превращений: гликоген → глюкоза → молочная кислота. Где имеют место указанные превращения и каково значение этого процесса?
88. Составьте уравнения реакций следующих превращений: лактоза → глюкоза → молочная кислота. В производстве каких пищевых продуктов имеют место указанные превращения?
89. Почему крахмал можно заменить клетчаткой в производстве этилового спитра? Составьте уравнения реакций, идущих при получении гидролизного этилового спирта из клетчатки, укажите практическое значение этой реакции.
90. Можно ли различить растворы глюкозы, сахарозы и крахмала, пользуясь только гидроксидом меди? Дайте обоснованный ответ и приведите уравнение наиболее характерной реакции.
Тема 9. Витамины. Ферменты.
91.Витамины: определение, классификация, значение. Понятие о гиповитаминозе, гипервитаминозе и авитаминозе.
92. Витамин С. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
93. Витамин D. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
94. Витамин В6. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
95. Витамин Е. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
96. Витамин В12. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
97. Витамин В2. Химическая природа, биологическая роль, содержание в продуктах питания, суточная потребность.
98. Химическая природа ферментов. Классификация ферментов.
99. Свойства ферментов. Виды специфичности ферментов.
100. Общее представление про ферментативный катализ. Использование ферментов в пищевой промышленности.
Литература
1. Белик В.В. Киенская К.И. Физическая и коллоидная химия-М.: Академия, 2008.
2. Горбунцова С.В. Физическая и коллоидная химия (в общественном питании) –М., «Альфа-М»; «ИНФРА-М»; 2010г.
3. Липатников В.Е., Казаков К.М. Физическая и коллоидная химия.-М.: Высшая школа, 2005.
4. Ищенко А.А. Аналитическая химия (СПО).- М.: Академия, 2007.
5. Жванко Ю.Н., Панкратова Г.В. Аналитическая химия и технохимический контроль в общественном питании.-М.: Высшая школа, 1989.
6. Саенко О.Е. Аналитическая химия: учебник для средних профессиональных учебных заведений. - Ростов – на –Дону: Феникс, 2009.
7. Гурецкая В.Л. Органическая химия.-М.: Высшая школа, 2004.
8. Пустовалова Л.М. Органическая химия.-Ростов-на-Дону: Феникс, 2005.
9. Дуденко Н.В., Павлоцкая Л.Ф. и др. Биологическая химия. -Харьков: Прапор, 1999.
 2020-10-10
2020-10-10 379
379








