| Неметалл | Способы получения | |
| Лабораторные | Промышленные | |
| Водород | 1. Взаимодействие металла с растворами кислот НС1, H2S04(разб.): Zn + 2HCl = ZnCl2+H2↑ 2. Электролиз воды: 2Н2О 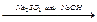 2Н2↑ +О2↑ 2Н2↑ +О2↑ | 1. Электролиз воды. 2. Конверсия метана: СН4 + 2Н2О 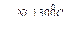 4Н2 + СО2 3. Конверсия углерода: а)С + Н2О 4Н2 + СО2 3. Конверсия углерода: а)С + Н2О 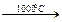 СО+Н2 водяной газ СО + Н2О + (Н2) СО+Н2 водяной газ СО + Н2О + (Н2) 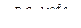 СО2 + Н2 4. Нагревание метана: СН4 СО2 + Н2 4. Нагревание метана: СН4 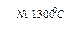 С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С) С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С) |
| Кислород | 1. Разложение различных солей: 2 КСlO3  2 КС1 + 3 О2↑ 2 КМnО4 2 КС1 + 3 О2↑ 2 КМnО4 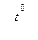 К2Мп04 + МnO2 + О2 2 NaNО3 К2Мп04 + МnO2 + О2 2 NaNО3 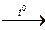 2 NaN02 + О2↑ 2. Электролиз воды. 2 NaN02 + О2↑ 2. Электролиз воды. | 1. Электролиз воды. 2. Фракционная перегонка жидкого воздуха, сначала испаряется азот (т.кип. -195,8 °С), а в жидком состоянии остается кислород (т.кип. -183 °С). |
| Хлор | Взаимодействие хлороводородной кислоты с окислителями: 4 HCl + МnO2 = Cl2↑+MnCl2+2H2O 16 НС1 + 2 КМn04 = 5 С12↑ + + 2 МnС12 + 2 КCl + 8 Н20 14 HCl + K2Cr2O7 = =3 Cl2↑+ 2 CrCl3 + 7 H2O + 2 KCl 6 HCl + KClO3 = 3Cl2↑+KCl+3 H2O | Электролиз концентрированного раствора хлорида натрия: 2 NaCl + 2 Н20 = С12↑ + H2↑ + 2 NaOH |
| Сера | Восстановление оксида серы (IV) сероводородом: SO2 + 2 H2S =3 S + 2 H2O | 1. Нагревание серного колчедана (пирита) до высоких температур без доступа воздуха: FeS2 = FeS + S 2. Восстановление оксида серы (IV) (побочный продукт металлургической и коксовой промышленности) углеродом (а) или сероводородом (б): а) SO2 + C 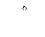 CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2O CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2O |
| Неметалл | Способы получения | |
| Лабораторные | Промышленные | |
| Азот | Разложение при нагревании нитрита аммония: NH4NO2 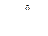 N2 + H2O N2 + H2O | Фракционная перегонка жидкого воздуха (см. получение кислорода) |
| Фосфор | Не получают | Прокаливание в электропечах при 1500 0С смеси фосфорита или апатита (основной компонент Ca3(PO4)2) с песком или углем: 2 Ca3(PO4)2 + 10 C + 6 SiO2= = 6 CaSiO3 + P4 + 10 CO |
| Кремний | Восстановление оксида кремния магнием или алюминием в электропечах: SiO2 + 2 Mg 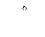 Si + 2 MgO 3 SiO2 + 4 Al Si + 2 MgO 3 SiO2 + 4 Al 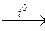 3 Si + 2 Al2O3 3 Si + 2 Al2O3 | 1. Восстановление оксида кремния коксом в электропечах: SiO2 + 2 C  Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn 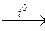 Si + 2 ZnCl2 Si + 2 ZnCl2 |
Физические свойства неметаллов.
Химическая связь – ковалентная неполярная
1. При обычной температуре неметаллы могут быть в разном агрегатном состоянии – твердые: S – сера, P - фосфор, I – йод, C - алмаз и графит; жидкие: Br2 - бром; газообразные: O2 - кислород, H2 - водород, N2 - азот, Cl2 - хлор, F2 - фтор.
2. Многие не проводят электрический ток (кроме графита и кремния).
3. Не проводят тепло.
4. В твердом состоянии – хрупкие.
5. Не имеют металлического блеска (кроме йода - I2, графита - C и кремния Si).
6. Цвет охватывает все цвета спектра (красный - красный фосфор, желтый – сера, зеленый - хлор, фиолетовый – пары йода).
7. Температура плавления изменяется в огромном интервале: tпл(N2) равна - 210 0C, а tпл алмаза равна 3730 0С.
8. Неметаллы образуют аллотропые модификации (углерод, сера, фосфор, кислород, мышьяк, кремний).
Многие неметаллы образуют молекулы, состоящие из двух атомов (H2, O2, N2, F2, Cl2, Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка. Но, с другой стороны, вещества с ковалентной неполярной связью образуют и самую прочную кристаллическую решётку - атомную (алмаз, кремний).
 2020-10-10
2020-10-10 3819
3819








