| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
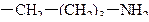 | Лизин | 2,6-диамино-гексановая | Лиз Lys |
 | Аргинин (содержит гунидиновую группу) | 2-амино-5-гуанидил-пентановая | Арг Arg |
Аминокислоты, которые содержат в радикале дополнительную карбоксильную или амидную группы:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
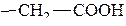 | Аспарагиновая | 2-аминобутан-диовая | Асп Asp |
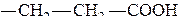 | Глутаминовая | 2-аминопентан-диовая | Глу Glu |
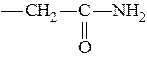 | Аспарагин | 2-амино-3-карбоксамидо-пропановая | Асн Asn |
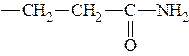 | Глутамин | 2-амино-4-карбоксамидо-бутановая | Глн Gln |
Ароматические и гетероциклические аминокислоты:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
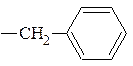 | Фенилаланин | 2-амино-3-фенил-пропановая | Фен Phe |
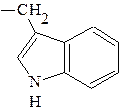 | Триптофан | 2-амино-3-индол-илпропановая | Три Trp |
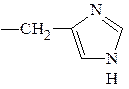 | Гистидин (иминокислота) | 2-амино-3-имидо-золилпропановая | Гис His |
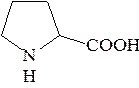 | Пролин (полная форма) | 2-пирролидин-карбоновая | Про Pro |
1.2. Стереоизомерия аминокислот
Все природные α-аминокислоты, кроме глицина (NH2 - CH2 - COOH), имеют асимметрический атом углерода (α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение
α-аминокислот принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
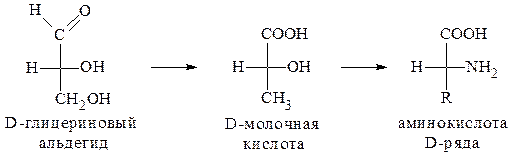
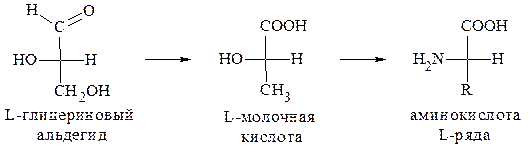
Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выполняются в соответствии с главным требованием - они не создают новых и не разрывают старых связей у асимметрического центра.
Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:
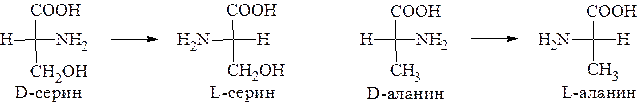
Природные аминокислоты, входящие в состав белков, относятся к L-ряду.
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. D- и L-аминокислот по разному действуют на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда - горькие или безвкусные.
2.Физические свойства аминокислот
Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств.
Аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна.
Аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде.
Аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.
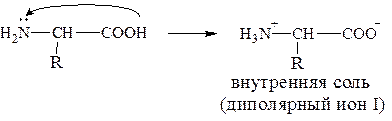
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание - амин.
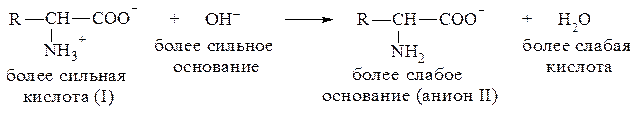
Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н3О+ отдает протон карбоксилат-иону и образуется более слабая кислота:

Ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
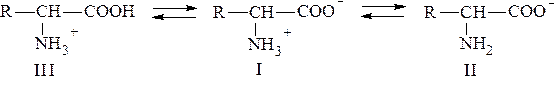
3.Химические свойства аминокислот
 2020-10-11
2020-10-11 710
710








