Кристалл можно представить как периодически повторяющиеся в пространстве одинаковые элементарные структурные единицы - элементарные ячейки кристалла, состоящие из одного, в простейшем случае, или нескольких атомов каждая.
Элементарная ячейка в общем случае имеет форму косоугольного параллелепипеда. Все расположенные в ней атомы принято называть базисом элементарной ячейки кристалла. Закономерности строения элементарной ячейки и базиса, в частности степень их симметричности определяет многие свойства кристалла, в первую очередь электрические, магнитные и механические. Элементарная ячейка может содержать как один, так и несколько атомов. Так у многих металлов, например железа, хрома, меди, серебра, она состоит из одного атома. В тех случаях когда, кристалл состоит из нескольких химических элементов, например, натрия и хлора, элементарная ячейка будет содержать как минимум два атома: натрий и хлор. Широко распространены кристаллы с элементарной ячейкой, состоящей из нескольких сцепленных друг с другом молекулярных групп, например кристаллы льда или же многих магнитных материалов. Существуют кристаллы, например, белковые, элементарная ячейка которых состоит из молекул, содержащих несколько тысяч атомов.
Выбор элементарной ячейки. Описание структуры любого кристалла можно и принято проводить, охарактеризовав его элементарную ячейку. Ясно, что выбрать элементарную ячейку одного и того же кристалла можно несколькими способами (рис. 1.1). При таком выборе стремятся к наиболее простой форме ячейки, в частности к наибольшему числу прямых углов, а также к минимальности ее объема. Ячейку с наименьшим объемом принято называть примитивной элементарной ячейкой. Однако часто выбирают элементарную ячейку большего объема, но более простой формы, содержащую несколько наборов атомов, формирующих базис элементарной ячейки. На рис. 1.1 изображена кристаллическая решетка 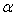 -железа. Проще всего ее представить как пространство, заполненное кубиками, в углах (1) и в центре (2) которых расположены атомы железа. Такую очень распространенную решетку принято называть объемно-центрированной кубической (ОЦК). Элементарную ячейку можно выбрать как косоугольный параллелепипед (б) с квадратным основанием. Однако за элементарную удобнее выбрать ячейку в 2 раза большего объема, но со всеми прямыми углами (а), она гораздо нагляднее, лучше отражает симметричность в расположении атомов, ее легче анализировать математически.
-железа. Проще всего ее представить как пространство, заполненное кубиками, в углах (1) и в центре (2) которых расположены атомы железа. Такую очень распространенную решетку принято называть объемно-центрированной кубической (ОЦК). Элементарную ячейку можно выбрать как косоугольный параллелепипед (б) с квадратным основанием. Однако за элементарную удобнее выбрать ячейку в 2 раза большего объема, но со всеми прямыми углами (а), она гораздо нагляднее, лучше отражает симметричность в расположении атомов, ее легче анализировать математически.
|
| Рис. 1.1. Выбор элементарной ячейки ОЦК решетки. |
Выбранную элементарную ячейку характеризуют тремя векторами основных трансляций 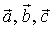 совпадающими с ее тремя ребрами, сходящимися в одной точке. Две точки с радиус-векторами
совпадающими с ее тремя ребрами, сходящимися в одной точке. Две точки с радиус-векторами  и
и  , связанные соотношением
, связанные соотношением  , где
, где 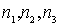 - целые числа, описывают одну и ту же точку базиса, но в разных элементарных ячейках кристалла. В таком случае удобно подробно охарактеризовать расположение атомов базиса в пределах одной элементарной ячейки, а всю структуру кристалла получить трансляцией - "тиражированием" данной ячейки, осуществляя параллельные переносы на векторы
- целые числа, описывают одну и ту же точку базиса, но в разных элементарных ячейках кристалла. В таком случае удобно подробно охарактеризовать расположение атомов базиса в пределах одной элементарной ячейки, а всю структуру кристалла получить трансляцией - "тиражированием" данной ячейки, осуществляя параллельные переносы на векторы  , называемые векторами трансляций. Можно сказать, что для полного описания структуры кристалла достаточно задать: 1) пространственную решетку, получаемую путем параллельных переносов на все векторы
, называемые векторами трансляций. Можно сказать, что для полного описания структуры кристалла достаточно задать: 1) пространственную решетку, получаемую путем параллельных переносов на все векторы  одной точки и 2) базис.
одной точки и 2) базис.
Пространственную решетку обычно характеризуют тремя векторами 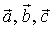 , задав их длины
, задав их длины 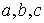 называемые периодами кристаллической решетки и углы
называемые периодами кристаллической решетки и углы  между ними; именно эти параметры обязательно содержатся во всех справочниках по структуре веществ [2,3].
между ними; именно эти параметры обязательно содержатся во всех справочниках по структуре веществ [2,3].
Базис принято задавать, описав положения всех атомов в одной ячейке набором радиус-векторов 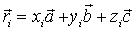 , числа
, числа  задают положения атомов в долях соответственно векторов
задают положения атомов в долях соответственно векторов  .
.
Число атомов в базисе удобно подсчитывать, просуммировав все атомы, отсеченные гранями ячейки и оказавшиеся внутри ячейки, складывая также и "половинки", "четвертинки" и "восьмушки" попавших внутрь атомов. В случае ячейки на рис. 1.1(б) внутрь ячейки попадает 8 восьмушек "угловых" атомов, считают, что такой базис состоит из 1 атома с координатами 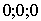 . Заметим, что в кристаллографии координаты атомов не заключают в круглые скобки, поскольку, как увидим далее, круглыми скобками принято обозначать кристаллические плоскости. В случае же ОЦК решетки (см. рис. 1.1 (а)) внутрь ячейки попадает один центральный и 8 восьмушек "угловых" атомов, то есть базис состоит из двух атомов: один занимает положение 1 с координатами
. Заметим, что в кристаллографии координаты атомов не заключают в круглые скобки, поскольку, как увидим далее, круглыми скобками принято обозначать кристаллические плоскости. В случае же ОЦК решетки (см. рис. 1.1 (а)) внутрь ячейки попадает один центральный и 8 восьмушек "угловых" атомов, то есть базис состоит из двух атомов: один занимает положение 1 с координатами 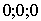 , а второй -
, а второй -  .
.
Структура очень многих соединений (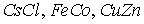 и многие другие) аналогична рассмотренной: положение 1 занимают атомы одного элемента, а положение 2 - другого (см. рис. 1.1 (а), отличаются они лишь длиной ребра куба, называемой периодом кубической кристаллической решетки. Такую элементарную ячейку называют структурой типа цезий хлор.
и многие другие) аналогична рассмотренной: положение 1 занимают атомы одного элемента, а положение 2 - другого (см. рис. 1.1 (а), отличаются они лишь длиной ребра куба, называемой периодом кубической кристаллической решетки. Такую элементарную ячейку называют структурой типа цезий хлор.
Симметрия кристаллических решеток. Кристаллические решетки большинства веществ имеют как правило несколько элементов симметрии. Существует несколько элементов симметрии. С элементом симметрии связана операция симметрии, при выполнении которой пространственная решетка переходит сама в себя. Элементом симметрии часто бывает поворотная ось на углы  , называемая соответственно осью вращения (или поворотной осью) 2-го, 3-го, 4-го и 6-го порядка. Приведенные на рис. 1.1 (а) и 1.2 решетки имеет много осей вращения, например оси четвертого порядка, оси третьего порядка, второго порядка. Другими элементами симметрии являются плоскость симметрии (часто ее называют зеркальной плоскостью) и центр симметрии (часто его называют центром инверсии).
, называемая соответственно осью вращения (или поворотной осью) 2-го, 3-го, 4-го и 6-го порядка. Приведенные на рис. 1.1 (а) и 1.2 решетки имеет много осей вращения, например оси четвертого порядка, оси третьего порядка, второго порядка. Другими элементами симметрии являются плоскость симметрии (часто ее называют зеркальной плоскостью) и центр симметрии (часто его называют центром инверсии).

|
| Рис. 1.2. Некоторые элементы симметрии куба: а) 3 плоскости симметрии, перпендикулярные ребрам куба; б, в) 4 из 6 плоскостей симметрии, перпендикулярные диагонали граней куба г) 2 из 6 осей симметрии 2-го порядка, параллельные диагоналям граней куба, проходящие через середины противоположных ребер; д) 3 оси симметрии 4-го порядка, перпендикулярные граням куба и проходящие через их центры; е) 4 оси симметрии 3-го порядка, параллельные диагоналям куба, проходящие через его вершины. |
Кубическая решетка (рис. 1.2) имеет три плоскости симметрии, параллельные граням, шесть диагональных плоскостей симметрии, перпендикулярных диагоналям граней, три оси четвертого порядка, шесть осей второго порядка, четыре оси третьего порядка и центр симметрии в центре куба. Существует строгая математическая теория групп, которая описывает в частности допустимые наборы операций симметрии кристаллической решетки [4].
Типы кристаллических решеток. С помощью теории групп было показано, что все многообразие кристаллов может быть описано с помощью 14 типов кристаллических решеток (решеток Браве), изображенных на рис. 1.3. Их принято группировать в семь систем, различающихся видом элементарной ячейки: триклинную, моноклинную, ромбическую, тетрагональную, тригональную, гексагональную и кубическую. Каждая система имеет свои соотношения между величинами  и
и 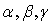 , приведенными в табл. 1. Некоторые из этих решеток имеют разновидности: примитивная -
, приведенными в табл. 1. Некоторые из этих решеток имеют разновидности: примитивная -  , объемноцентрированная (ОЦ) -
, объемноцентрированная (ОЦ) - 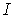 , гранецентрированная (ГЦ) -
, гранецентрированная (ГЦ) - 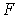 и с одной парой центрированных противоположных граней -
и с одной парой центрированных противоположных граней -  .
.
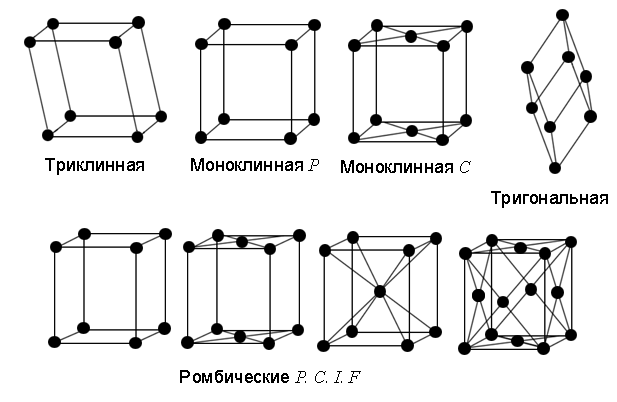
|
| Рис. 1.3а. Решетки Браве. |

|
| Рис. 1.3б. Решетки Браве. |
1. В триклинной системе как все углы не равны друг другу так и все длины сторон не равны друг другу. Данная решетка имеет центр симметрии в центре элементарной ячейки.
2. В моноклинной системе ячейка имеет форму прямой призмы с ребрами разной длины. Ячейка может быть с центрированными основаниями прямой призмы  и примитивной
и примитивной  . У такой решетки добавляются элементы симметрии: плоскость симметрии, параллельная основанию прямой призмы, и ось вращения 2-го порядка, проходящая через середины оснований.
. У такой решетки добавляются элементы симметрии: плоскость симметрии, параллельная основанию прямой призмы, и ось вращения 2-го порядка, проходящая через середины оснований.
3. В ромбической системе ячейка имеет форму прямоугольного параллелепипеда с ребрами разной длины. Ячейка имеет все 4 разновидности:  . У такой решетки еще больше элементов симметрии: три плоскости симметрии, параллельные граням, и три оси вращения 2-го порядка, проходящие через середины противоположных одинаковых граней.
. У такой решетки еще больше элементов симметрии: три плоскости симметрии, параллельные граням, и три оси вращения 2-го порядка, проходящие через середины противоположных одинаковых граней.
4. В тетрагональной системе ячейка имеет форму прямоугольного параллелепипеда с квадратным основанием. Ячейка может быть примитивной  и ОЦ
и ОЦ 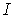 . По сравнению с предыдущей решеткой у нее появляется ось вращения 4-го порядка и несколько плоскостей симметрии.
. По сравнению с предыдущей решеткой у нее появляется ось вращения 4-го порядка и несколько плоскостей симметрии.
5. В кубической системе ячейка имеет форму куба. Ячейка может быть с центрированными гранями куба (ГЦК - гранецентрированный куб) или центром (ОЦК - объемноцентрированный куб). Это самая симметричная решетка, элементы симметрии которой мы рассматривали выше (см. рис. 1.2).
6. В гексагональной системе ячейка имеет форму прямой призмы с ромбом в основании, причем угол в ромбе равен 60 градусам. Часто рассматривают утроенную ячейку (см. рис. 1.4), имеющую вид правильной шестигранной призмы с осью симметрии шестого порядка (отсюда и ее название).
7. В тригональной системе ячейку принято выбирать в виде ромбоэдра, все грани которого - одинаковые ромбы с углом при вершине  . Заметим, что в случае ОЦК и ГЦК решеток можно выбрать элементарную тригональную ячейку с объемом в 2 и 4 раза меньшим, чем выбранная кубическая (см. задачу. 1.1).
. Заметим, что в случае ОЦК и ГЦК решеток можно выбрать элементарную тригональную ячейку с объемом в 2 и 4 раза меньшим, чем выбранная кубическая (см. задачу. 1.1).
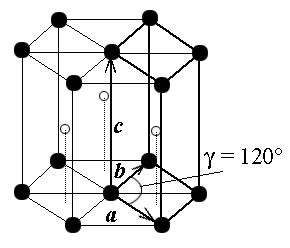
|
| Рис. 1.4а. Элементарные ячейки гексагональной решетки. |
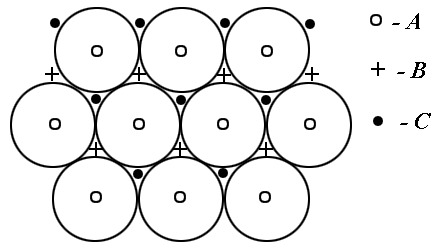
|
| Рис. 1.4б. Варианты расположения атомов в плотноупакованных структурах (б). |
Все другие "типы" решеток которые, казалось бы должны существовать, например изображенная на рис. 1.1 решетка "б" с квадратом в основании, могут быть сведены выбором других векторов 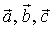 к одному из указанных выше типов.
к одному из указанных выше типов.
Симметрия решетки определяет анизотропию (различные значения по различным направлениям) физических свойств. Анизотропия некоторых физических свойств может быть предсказана по виду элементарной ячейки. Например для ромбической, моноклинной и триклинной решеток, обладающих сравнительно малым числом элементов симметрии, наблюдается анизотропия многих характеристик, рассмотренных в главах 3-5, например относительной электрической проницаемости, коэффициента теплопроводности. Эти характеристики веществ обычно описывают матрицами второго порядка [4-6]. В случае симметричной кубической решетки эти величины могут превратиться в скалярные; в случае тетрагональной или гексагональной решетки свойства кристалла могут оказаться одинаковыми в плоскости перпендикулярной ребру с. Достаточно подробно связь симметрии кристаллической решетки с симметричностью тензоров, описывающих различные физические свойства, рассматривается в литературе по кристаллографии, например [4-6].
Ячейка Вигнера-Зейца. Существует способ выбора элементарной ячейки, называемой ячейкой Вигнера-Зейца, используемой в последующих главах для анализа движения частиц в кристалле. Для выбора ячейки выделяют область пространства "более приближенную" к данному узлу кристаллической решетки, чем к другим. Для этого соединяют выбранный узел с одним из ближайших (или иногда также и следующими за ближайшими) его соседей отрезком, находят его середину и через нее проводят перпендикулярную данному отрезку плоскость, делящую пространство на два полупространства. Выделяют полупространство, содержащее выбранный узел. Такую операцию повторяют со всеми соседями выбранного узла. Пересечение всех выделенных полупространств и даст ячейку Вигнера-Зейца. Можно легко показать, например, что в случае примитивных кубической, тетрагональной и ромбической решеток ячейка Вигнера-Зейца по форме и размерам совпадает с элементарной ячейкой, а ее центр совпадает с узлом решетки. В случае ОЦК и ГЦК решеток ячейка Вигнера-Зейца имеет более сложную форму [1].
Направление в кристаллической решетке. Направление в кристаллической решетке задают координатами их направляющего вектора в базисных векторах 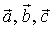 , обычно их заключают в квадратные скобки. При этом знак минуса в случае отрицательности координаты изображают над числом. Наиболее важные направления задаются как правило целыми числами. На рис. 1.2 направление
, обычно их заключают в квадратные скобки. При этом знак минуса в случае отрицательности координаты изображают над числом. Наиболее важные направления задаются как правило целыми числами. На рис. 1.2 направление 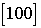 параллельно ребру куба, направление
параллельно ребру куба, направление  параллельно пространственной диагонали куба, а направления
параллельно пространственной диагонали куба, а направления 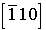 и
и  - диагоналям его нижнего основания. Некоторые направления в силу симметричности решетки, например кубической, физически равноценны, например
- диагоналям его нижнего основания. Некоторые направления в силу симметричности решетки, например кубической, физически равноценны, например  ,
,  ,
,  и
и  . Для описания такого семейства направлений используют треугольные скобки
. Для описания такого семейства направлений используют треугольные скобки 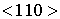 .
.
Кристаллографические плоскости. В кристалле большое значение имеют особые кристаллографические плоскости, проходящие через узлы кристаллической решетки. Именно кристаллографические плоскости, на которых расположено большое количество узлов кристаллической решетки, важны как для предсказания огранки кристалла, так и при рассмотрении движения частиц в нем (см. разд. 1.3 и главы 3 и 4).
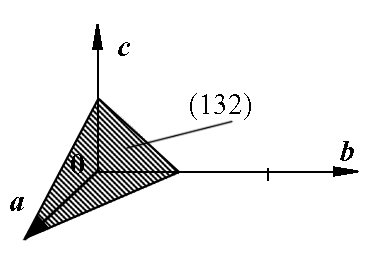
Кристаллографические плоскости принято описывать индексами Миллера - набором трех целых чисел, заключенных в круглые скобки 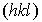 . Знак минус отрицательного индекса принято ставить над ним. Эти индексы имеют простой геометрический смысл. Если вдоль трех координатных осей, заданных векторами
. Знак минус отрицательного индекса принято ставить над ним. Эти индексы имеют простой геометрический смысл. Если вдоль трех координатных осей, заданных векторами  , отложить соответственно отрезки с длинами
, отложить соответственно отрезки с длинами 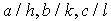 (см. рис. 1.5), то получившиеся три точки однозначно зададут проходящую через них плоскость
(см. рис. 1.5), то получившиеся три точки однозначно зададут проходящую через них плоскость 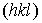 . На рис. 1.6 показаны плоскости
. На рис. 1.6 показаны плоскости  . Заметим, что параллельно изображенной на рис. 1.5 плоскости можно провести много параллельных плоскостей проходящих через узлы кристаллической решетки, откладывая по осям отрезки с длинами
. Заметим, что параллельно изображенной на рис. 1.5 плоскости можно провести много параллельных плоскостей проходящих через узлы кристаллической решетки, откладывая по осям отрезки с длинами 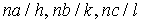 (
(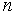 - целое число) расстояние между такими ближайшими плоскостями называется межплоскостным расстоянием
- целое число) расстояние между такими ближайшими плоскостями называется межплоскостным расстоянием 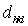 системы плоскостей
системы плоскостей 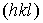 . Величину
. Величину 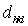 удобно вычислять как расстояние от точки (000) до ближайшей к ней плоскости
удобно вычислять как расстояние от точки (000) до ближайшей к ней плоскости 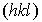 (см. рис. 1.5). В кристаллах с кубической ячейкой индексы Миллера плоскости совпадают с координатами направления вектора нормали к ней, в случае других ячеек это как правило не так.
(см. рис. 1.5). В кристаллах с кубической ячейкой индексы Миллера плоскости совпадают с координатами направления вектора нормали к ней, в случае других ячеек это как правило не так.
|
| Рис. 1.5. Геометрический смысл индексов Миллера плоскости в кристалле. |

|
| Рис. 1.6. Некоторые кристаллографические плоскости кубической решетки. |
Рассмотрим наиболее часто встречающиеся структуры.
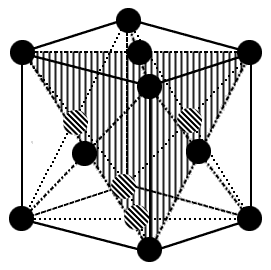
Гранецентрированная кубическая решетка характеризуется ячейкой изображенной на рис. 1.7. Узлы расположены по углам куба и по центрам его граней. Всего в ячейке получается 4 узла (8 восьмушек и 6 половинок). Видно, что каждый атом в ней имеет 12 ближайших соседей на расстоянии  . Такую решетку имеют многие металлы (железо, кобальт, медь и многие другие), их атомы расположены в узлах рассмотренной решетки. Заметим, что, строго говоря, базис ГЦК решетки Браве (рис. 1.3) состоит из одного атома, хотя чаще выбирают ячейку в виде куба, как это сделано выше, и рассматривают базис из 4 атомов. Как увидим ниже, многие структуры как бы состоят из нескольких смещенных относительно друг друга ГЦК решеток.
. Такую решетку имеют многие металлы (железо, кобальт, медь и многие другие), их атомы расположены в узлах рассмотренной решетки. Заметим, что, строго говоря, базис ГЦК решетки Браве (рис. 1.3) состоит из одного атома, хотя чаще выбирают ячейку в виде куба, как это сделано выше, и рассматривают базис из 4 атомов. Как увидим ниже, многие структуры как бы состоят из нескольких смещенных относительно друг друга ГЦК решеток.
|
| Рис. 1.7. Элементарная ячейка ГЦК решетки. |
Структура типа 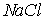 . (рис. 1.8) может быть представлена как решетка ГЦК с атомами натрия по узлам и атомами хлора, смещенными относительно них на 1/2 пространственной диагонали. Базисом ГЦК решетки Браве в таком случае будут два атома: натрия с координатами
. (рис. 1.8) может быть представлена как решетка ГЦК с атомами натрия по узлам и атомами хлора, смещенными относительно них на 1/2 пространственной диагонали. Базисом ГЦК решетки Браве в таком случае будут два атома: натрия с координатами 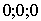 и хлора с координатами
и хлора с координатами  . Чаще за элементарную ячейку берут куб с базисом из 8 атомов, содержащий 4 атома натрия и 4 атома хлора с координатами:
. Чаще за элементарную ячейку берут куб с базисом из 8 атомов, содержащий 4 атома натрия и 4 атома хлора с координатами:
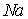 : 0 0 0; 1/2 1/2 0; 1/2 0 1/2; 0 1/2 1/2;
: 0 0 0; 1/2 1/2 0; 1/2 0 1/2; 0 1/2 1/2;
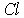 : 0 0 1/2; 0 1/2 0; 1/2 0 0; 1/2 1/2 1/2.
: 0 0 1/2; 0 1/2 0; 1/2 0 0; 1/2 1/2 1/2.
Такую структуру, имеют многие кристаллы (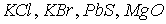 и др.), отличающиеся лишь периодом решетки
и др.), отличающиеся лишь периодом решетки 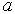 .
.

|
| Рис. 1.8. Элементарная ячейка NaCl |
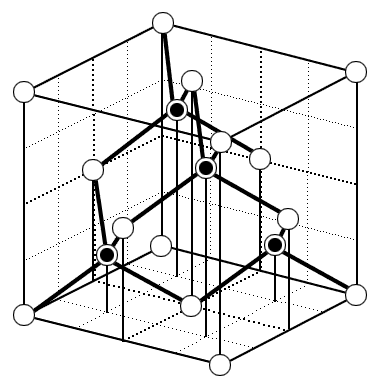
Структура алмаза (рис. 1.9) может быть представлена как решетка ГЦК с атомами по узлам и смещенными относительно них на 1/4 пространственной диагонали. Базисом такой ГЦК решетки Браве будут два атома: с координатами 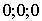 и
и 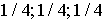 . Часто за элементарную ячейку алмаза выбирают куб с базисом из 8 атомов с координатами:
. Часто за элементарную ячейку алмаза выбирают куб с базисом из 8 атомов с координатами:
для четырех атомов несмещенной ГЦК решетки:
0 0 0; 0 1/2 1/2; 1/2 0 1/2; 1/2 1/2 0
для четырех атомов смещенной ГЦК решетки:
1/4 1/4 1/4; 1/4 3/4 3/4; 3/4 1/4 3/4; 3/4 3/4 1/4.
|
| Рис. 1.9. Элементарная ячейка алмаза (и светлые и темные шарики - атомы углерода) и сульфида цинка (темные шарики - атомы серы, светлые шарики - атомы цинка). |
Можно показать, что каждый атом углерода окружен четырьмя ближайшими соседями на расстоянии 1/4 длины пространственной диагонали, расположенными относительно него как углы правильного тетраэдра относительно его центра (см. задачу 1.2), с ними он соединен ковалентными связями, образующими равные углы друг с другом (см. след. раздел). Помимо углерода (алмаза) такую структуру имеют четырехвалентные полупроводники кремний и германий.
Структура типа сульфида цинка (кубическая модификация) получается из описанной выше структуры алмаза если атомы цинка поместить в "несмещенную решетку", а атомы серы - в "смещенную". В такой структуре каждый атом одного сорта (серы, например) находится рядом с четырьмя ближайшими соседями - атомами другого сорта (атомы цинка), с которыми он соединен ковалентными связями, образующими равные углы друг с другом.
Гексагональная структура изображена на рис. 1.4. Удобно изображать три элементарные ячейки, тогда структура напоминает слоистые пчелиные соты. Многие вещества обладают такой структурой, в которой группы атомов образуют в пространстве правильные шестиугольники. Часто встречается разновидность этой структуры: гексагональная с плотной упаковкой (ГПУ). Ее можно представить слоями (см. рис.1.4 б): первый слой (А) - атомы-шары, расположенные плотно шестигранниками по узлам нижней плоскости. Атомы второго слоя (В) располагаются по центрам трех "ячеек" в "ямках" между атомами нижнего слоя, касаясь их. Атомы третьего слоя располагаются как на рис.1.4 над атомами первого слоя и в ямках между атомами второго слоя. Наблюдается периодичность укладки слоев в направлении вектора  с периодом
с периодом 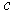 :
:  В итоге получается плотноупакованная структура шаров, в которой у каждого шара имеется по 12 ближайших соседей на расстоянии равном двум радиусам шаров. Можно вычислить, что в такой структуре отношение
В итоге получается плотноупакованная структура шаров, в которой у каждого шара имеется по 12 ближайших соседей на расстоянии равном двум радиусам шаров. Можно вычислить, что в такой структуре отношение  . Многие металлы имеют такую структуру, правда с несколько отличающимся отношением
. Многие металлы имеют такую структуру, правда с несколько отличающимся отношением  , равным, к примеру 1,622 для
, равным, к примеру 1,622 для 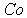 , 1623 для
, 1623 для 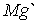 , 1,586 для
, 1,586 для  .
.
Заметим, что существует еще один способ укладки шаров: два первых слоя укладываются как и прежде, а третий 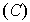 укладывают в другие ямки, так, что атомы третьего слоя окажутся в местах, отмеченных на рис. 1.4 крестиками. Четвертый слой укладывают как первый, пятый как второй и так далее. Наблюдается периодичность укладки слоев в направлении вектора
укладывают в другие ямки, так, что атомы третьего слоя окажутся в местах, отмеченных на рис. 1.4 крестиками. Четвертый слой укладывают как первый, пятый как второй и так далее. Наблюдается периодичность укладки слоев в направлении вектора  с периодом
с периодом  :
:  Получается еще один способ плотной укладки шаров с числом ближайших соседей равным 12. Можно показать, что такая структура соответствует рассмотренной выше ГЦК решетке (см. рис. 1.7), направление [111] которой совпадает с направлением вектора
Получается еще один способ плотной укладки шаров с числом ближайших соседей равным 12. Можно показать, что такая структура соответствует рассмотренной выше ГЦК решетке (см. рис. 1.7), направление [111] которой совпадает с направлением вектора  на рис. 1.4.
на рис. 1.4.
Рассмотренные ГПУ и ГЦК структуры очень похожи, отличаются они лишь чередованием слоев плотноупакованных атомов, энергии их образования должны быть почти одинаковыми. Поэтому многие металлы имеют при слегка меняющихся условиях (например, при разных температурах) ГПУ и ГЦК решетки. Например, неодим имеет при низких температурах решетку ГЦК, а при высоких - ГПУ.
Некоторые металлы и сплавы имеют дефекты упаковки рассмотренных выше слоев атомов (см. рис. 1.4), когда слои укладываются с нарушением их порядка, например 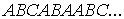 В результате решетку нельзя строго говоря считать ни как ГПУ, ни как ГЦК.
В результате решетку нельзя строго говоря считать ни как ГПУ, ни как ГЦК.
Многие вещества имеют при разных условиях (например, температуре, давлении) разные кристаллические решетки. Так железо при комнатной температуре имеет решетку ОЦК, при температурах 910-1400 0С - ГЦК, а при еще более высоких температурах - опять ОЦК. Часто две решетки сосуществуют в одном куске вещества: одна как равновесная, а другая - как метастабильная, не успевшая переформироваться в равновесную. Такая ситуация наблюдается, например, в сталях (сплавах Fe-C) после их закалки: выдержке при температуре существования ГЦК решетки и быстрого охлаждения до комнатной температуры, когда стабильной оказывается ОЦК решетка. После закалки получается сложная система областей вещества с ОЦК и ГЦК решетками. Форма и расположение этих областей вещества с разными решетками определяет многие свойства материала.
 2020-10-12
2020-10-12 168
168







