Для характеристики
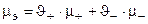
Лекция №3
Пример: а) Для раствора электролита NaCl средняя активность ионов в растворе равна:

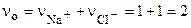
а активность электролита NaCI равна
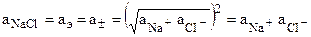

б) Для раствора CaCl2 средняя активность ионов
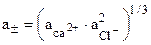
активность электролита СаСl2 равна
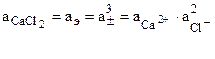 , т.е.
, т.е.
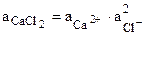
Для разбавленных растворов при комнатной температуре ¡±=f±.
Зависимость среднего коэффициента ионной активности электролита от валентности ионов и от концентрации раствора
Активность ионов электролита связана с концентрацией ионов в растворе через коэффициент активности
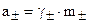 ;
; 
Сам же коэффициент активности f± или ¡± не является величиной постоянной для разных электролитов и для одного электролита при изменении его концентрации. Физическая сущность его состоит в том, что он выражает интенсивность электрического поля в растворе электролита и меру взаимного влияния ионов в растворе. В очень разбавленных растворах аi=mi и g±=1, т.е. интенсивность электрического поля ®0. В неразбавленном растворе g±<1. В качестве меры интенсивности электрического поля раствора электролита Льюис предложил величину, называемую ионной силой раствора. Она определяется так:
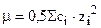
или 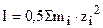
в зависимости от того в молярной или моляльной форме выражена концентрация.
где – сi,mi – концентрация i-го иона в растворе, zi – заряд i-го иона. (в бесконечно разбавленных растворах при сi®0, сi=mi и ¡i=fi.
То есть m=f(с,z) – ионная сила раствора электролита есть функция его концентрации в растворе и заряда ионов.
Являясь характеристикой интенсивности электрического поля коэффициент активности ионов электролита является функцией ионной силы раствора, а следовательно, функцией С и Z.
f±=F(m)=F¢(c,z).
Исследуя зависимости коэффициентов активности электролитов от их концентраций в растворе в присутствии посторонних электролитов Льюис и Рендалл обнаружили, что в разбавленных растворах средний коэффициент активности данного электролита и ионов ¡± (или f±) приблизительно одинаков во всех растворах с одинаковой ионной силой, независимо от того обусловлена ли величина ионной силы присутствием данного электролита или других солей. Это правило получило название эмпирического закона ионной силы. Оно подчеркивает, что величина среднего коэффициента активности ионов электролита не зависит от его химической природы, а определяется лишь концентрацией и зарядом находящихся в растворе ионов, т.е. интенсивностью электрического поля в растворе. Правило ионной силы применимо для разбавленных (с£0,05 моль/л) растворов со сравнительно небольшой величиной ионной силы. С увеличением концентрации раствора начинает проявляться химическая природа ионов, вследствие их большой плотности, и правило ионной сила становится неприменимым.
Количественное выражение коэффициента активности и объяснение правила ионной силы дала теория электролитов Дебая и Гюккеля.
 2014-02-04
2014-02-04 2202
2202
