Таблица. Коэффициенты активности одно, двух, и трех валентных ионов при 25оС
| Валентность | Величина fi при ионной силе раствора | ||||
| 10-3 | 5×10-3 | 10-2 | 5×10-2 | 10-1 | |
| 0,97 | 0,93 | 0,90 | 0,81 | 0,76 | |
| 0,87 | 0,74 | 0,66 | 0,44 | 0,33 | |
| 0,73 | 0,54 | 0,39 | 0,15 | 0,08 |
Из таблицы видно, что с увеличением m и увеличением zш коэффициент активности ионов сильно понижается. Наоборот, по мере разбавления раствора коэффициенты активности стремятся к 1, а сами активности – к фактическим концентрациям ионов: fi®1; ai®ci.
Расчетные значения коэффициентов активности ионов по формуле Дебая-Гюккеля хорошо согласуются со значениями, найденными опытным путем при значениях ионной силы раствора m£0,2. При m £ 0,2 начинают наблюдаться расхождения между расчетным и аналитическими значениями (особенно для 2-х и 3-х валентных ионов).
В заключение следует отметить, что в растворах слабых электролитов концентрация ионов настолько мала, что взаимодействием между ионами здесь можно пренебречь, а сами растворы считать, как идеальные, которые подчиняются закону действия масс. Т.е. (f±)сл.эл.®1, (а±)сл.эл.®с±.
При этом в выражение константы диссоциации при расчетах можно подставлять концентрации ионов, а не их активности. Так для уравнения
НАn «H++An-
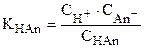
Однако, если в растворе одновременно присутствуют слабый и сильный электролит, например, Н2СО3, то необходимо равновесие диссоциации слабого электролита выражать через активности. Коэффициент активности недиссоциированных молекул равен 1, т.е.
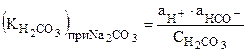 .
.
Пример: Найти коэффициент активности ионов Na+ и SO42- и средний мольный коэффициент активности электролита Na2SO4 в 0,01М растворе Na2SO4.
Na2SO4®2Na++SO42-
CNa=0,02 г-моль/л; СSO4=0,01 г-моль/л.
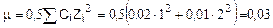
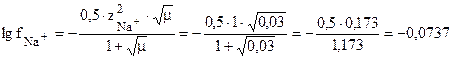 fNa+=0,844
fNa+=0,844
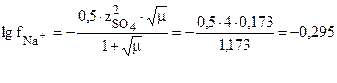
fSO42-=0,507
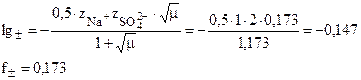
 2014-02-04
2014-02-04 672
672








