Электролитическая диссоциация
Тема 4. Теория растворов электролитов.
Лекция №2
Ограниченность теории электролитической диссоциации Аррениуса заключалась в том, что он представлял раствор электролита как механическую смесь молекул растворителя, молекул и ионов растворенного вещества, не учитывая возможность электростатического взаимодействия между отдельными частицами в растворе электролита. Игнорирование этого часто приводило к противоречию выводов теории электролитической диссоциации с опытом (пример с электропроводностью концентрированной соли: cтеор., cопыта).
В настоящее время принято считать, что в основе процесса электролитической диссоциации лежит электростатическое взаимодействие молекул растворителя с растворяемым веществом. Одним из обязательных условий такого взаимодействия является присутствие в рассматриваемой системе полярных молекул, так как достаточно эффективным может быть электростатическое взаимодействие только между полярными молекулами. Таким образом, процесс электролитической диссоциации возможен лишь в полярных арстворителях, одним из которых является вода.
Физико-химический смысл процесса электрической диссоциации состоит в следующем.
Твердые вещества, проявляющие свойства электролитов, являются, как правило, кристаллическими телами. Переход ионов из кристалла в раствор происходит в результате взаимодействия их с полярными молекулами растворителя, которые, разрушая кристалл, втягивают ионы из кристаллической решетки в объем раствора.
Электростатическое взаимодействие молекул растворителя с ионами электролита в объеме раствора приводит к созданию вокруг каждого иона оболочки из молекул растворителя. Эта оболочка называется гидратной, если растворитель – вода и сольватной – в общем случае, когда речь идет о любом полярном растворителе.
Аналогично происходит электролитическая диссоциация жидких электролитов, имеющих полярные молекулы, например НСI. В этом случае сначала ослабевает связь между противоположно заряженными частями молекулы электролита, в результате воздействия полярных молекул воды, а затем наступает разрыв молекулы электролита на ионы. Образовавшиеся ионы в растворителе взаимодействуют друг с другом и, в принципе, могут соединиться опять в молекулу. Приближенно силу электролитического взаимодействия ионов можно оценить по закону Кулона:
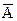 ,
,
где z1 и z2 – заряды катиона и аниона; r – расстояние между катионами, и анионами; D – диэлектрическая проницаемость среды.
Очевидно, чем больше диэлектрическая проницаемость среды, тем меньше взаимное электростатическое притяжение ионов, а следовательно, тем больше вероятность их существования в свободном состоянии. (При гидратации ионов в растворе, между отдельными ионами располагаются молекулы воды). Таким образом, растворители с высокой диэлектрической проницаемостью, например, вода (D=81 при 180С), будут обладать хорошей диссоцирующей способностью, а растворители с низкой D, например, бензол (D=2,3 при 200С) диссоцирующей способностью обладать не будут.
 2014-02-04
2014-02-04 606
606







