Первые четыре представителя ряда кислот – жидкости, смешиваются с водой во всех соотношениях, имеют острый запах. Кислоты, в молекуле которых содержится от пяти до девяти атомов углерода (а также изомасляная кислота), маслянисты; растворимость их в воде невелика, обладают неприятным запахом. Высшие кислоты – твёрдые вещества, практически не растворимы в воде, запаха не имеют, при перегонке под обыкновенным давлением они разлагаются.
1. Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе >C=O молекулы карбоновых кислот способны к электролитической диссоциации
R–COOH ↔ R–COO- + H+
Способность карбоновых кислот к диссоциации зависит и от влияния связанного с карбоксилом углеводородного радикала. Самой сильной одноосновной кислотой является муравьиная 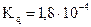 , в которой карбоксильная группировка не связана с радикалом. Другие кислотызначительно слабее муравьиной кислоты. Это объясняется электронодонорными свойствами алкильных радикалов; они вызывают смещение электронов связи R-C, а это в свою очередь уменьшает его влияние на гидроксильную группу. Введение в радикал кислоты атомов галогенов увеличивает их кислотные свойства (
, в которой карбоксильная группировка не связана с радикалом. Другие кислотызначительно слабее муравьиной кислоты. Это объясняется электронодонорными свойствами алкильных радикалов; они вызывают смещение электронов связи R-C, а это в свою очередь уменьшает его влияние на гидроксильную группу. Введение в радикал кислоты атомов галогенов увеличивает их кислотные свойства (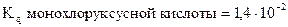 ;
; 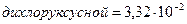 и трихлоруксусной =
и трихлоруксусной = 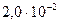 )
)
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот
2СH3COOH + Mg → (CH3COO)2Mg + H2↑
2СH3COOH + СaO → (CH3COO)2Ca + H2O
H–COOH + NaOH → H–COONa + H2O
2СH3CH2COOH + Na2CO3 → 2CH3CH2COONa + H2O + CO2↑
СH3CH2COOH + NaHCO3 → CH3CH2COONa + H2O + CO2↑
Карбоновые кислоты слабее многих сильных минеральных кислот (HCℓ, H2SO4 и т.д.) и поэтому вытесняются ими из солей
СH3COONa + H2SO4(конц.) 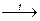 CH3COOH + NaHSO4
CH3COOH + NaHSO4
3. Реакция этерификации
CH3– –OH+ HO–CH3
–OH+ HO–CH3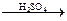 CH3–
CH3– –OCH3+ H2O
–OCH3+ H2O
метиловый эфир уксусной кислоты
(метилацетат)
4. Галогенирование. При действии галогенов (в присутствии красного фосфора (Р)) образуются α-галогензамещенные кислоты
| α | |
CH3–CH2–COOH 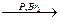 CH3– CH3– | CH–COOH + HBr | Br |
α -бромпропионовая кислота (2-бромпропановая кислота)
 2014-02-02
2014-02-02 786
786








