Спектры многоэлектронных атомов
а. Закон сохранения энергии. Выражается правилом частот Бора 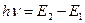 . (7.1)
. (7.1)
Энергия излученного (поглощенного) фотона равна разности энергий излучающего (поглощающего) атома.
б. Закон сохранения импульса. Проявляется в том, что свободный атом при излучении (поглощении) испытывает отдачу. Если принять импульс атома массой ma до испускания фотона за нуль, то в проекции на направление испускания фотона получаем равенство:
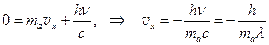 . (7.2)
. (7.2)
Знак “минус” указывает на то, что атом “отскакивает” в направлении, обратном направлению движения фотона. При поглощении фотона направление скорости отдачи совпадает с направленим движения фотона 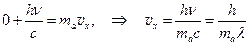 . (7.3)
. (7.3)
Скорость отдачи атомов при испускании света в ИК, видимом и УФ диапазонах невелика. Например, атом водорода, испуская фиолетовый фотон серии Бальмера с l = 410 нм, получает скорость отдачи vx = hçmal = 6,6·10-34 ç (0,001 ç 6·1023)·410·10-9 = 1м ç с. Это в 1000 раз меньше скорости теплового движения атомов.
За счет отдачи часть энергии излучения уносится атомом. Поэтому с учетом отдачи закон сохранения энергии принимает вид: 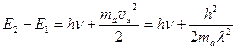 . (7.4)
. (7.4)
Энергия отдачи атомов очень мала. У атома водорода в выше приведенном примере она не превышает 10-8 от энергии фотона. За счет отдачи атомов энергия и частота излучаемых фотонов уменьшаются. В ИК, видимом и УФ диапазонах в силу малости эффектами, связанными с отдачей, обычно пренебрегают. И лишь в рентгеновском и гамма – диапазонах эти эффекты становятся существенными.
в. Закон сохранения момента импульса. Как показывает опыт, фотоны, как и электроны, обладают спиновым механическим моментом LS, который в два раза больше спинового механического момента электрона. В проекции на направление движения спиновый момент импульса фотона может принимать два значения, 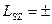 ħ. (7.5)
ħ. (7.5)
Испуская или поглощая фотон, атом не только отдает или получает энергию, но и меняет свой момент импульса на величину, равную моменту импульса фотона. Это изменение может происходить как за счет изменения конфигурации электронного облака (изменения орбитального момента электрона), так и за счет изменения ориентации спина электрона.
В первом случае речь идет об изменении орбитального механического момента электрона на величину ħ, что соответствует изменению азимутального квантового числа l на единицу. Отсюда получаем правило отбора (5.12), которое выражает собой, таким образом, закон сохранения момента импульса.
Второй путь – изменение ориентации спина электрона тоже на величину ħ. Этот путь имеет очень малую вероятность. Поэтому переходы с нарушением правила отбора D l = ± 1 в земных источниках света практически не реализуются. Например, переходы возбужденного атома водорода из 2 s - в 1 s - состояние могут происходить лишь в очень разреженных солнечной короне или в атмосферах звезд. Возбужденные атомы здесь длительное время не испытывают столкновений. Поэтому в них реализуются даже столь маловероятные переходы.
2. Спектры щелочных металлов более других элементов похожи на спектр водорода. Атомы щелочных металлов представляют собой центрально – симметричный остов с оболочкой инертного газа и общим зарядом + e, вокруг которого движется один электрон.
Щелочные металлы образуют главную подгруппу первой группы таблицы Менделеева. С них начинаются все периоды. Из стабильных элементов – это литий Li, Z = 3 (остов - ядро с оболочкой гелия, верхний электрон в невозбужденном атоме в 2 s - состоянии), натрий Na, Z = 11 (остов – ядро с оболочкой неона, электрон в 3 s - состоянии), калий K, Z = 19(остов – ядро с оболочкой аргона, электрон в 4 s - состоянии), рубидий Rb, Z = 37 (остов – ядро с оболочкой криптона, электрон в 5 s - состоянии), цезий Cs, Z = 55 (остов – ядро с оболочкой ксенона, электрон в 6 s - состоянии).
В спектрах щелочных металлов выделяют несколько серий. Важнейшие из них 4: главная, резкая, диффузная и основная. В 1900 году Иоганнес Ридберг нашёл общий вид сериальной формулы для щелочных металлов. 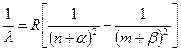 . (7.6)
. (7.6)
Здесь n £ m – номера энергетических уровней, a и b - поправки, имеющие разное значение для разных металлов и для разных серий.
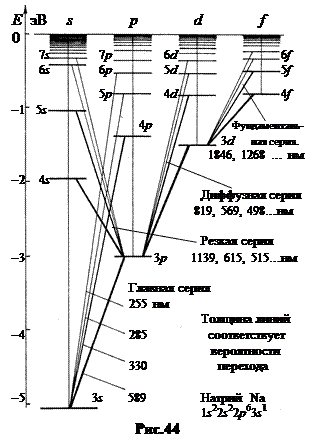
Рассмотрим в качестве примера спектр натрия. На рисунке 44 показаны уровни энергии в атоме натрия и схемы электронных переходов, формирующих спектральные серии.
 а. Главная серия. Названа так потому, что есть не только в спектрах излучения, но и в спектрах поглощения. Соответствует серии Лаймана в спектре водорода. Для натрия описывается формулой (m = 3,4,5,…¥):
а. Главная серия. Названа так потому, что есть не только в спектрах излучения, но и в спектрах поглощения. Соответствует серии Лаймана в спектре водорода. Для натрия описывается формулой (m = 3,4,5,…¥):
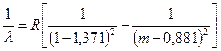 . (7.7)
. (7.7)
В спектре излучения главная серия возникает при переходе электрона из p – состояний в основное 3 s – состояние. Головная линия этой серии(то есть линия с максимальной длиной волны l, соответствующая минимальному значению числа m = 3) – характерная яркая желтая D – линия натрия с l =589 нм. Это единственная линия этой серии в видимом диапазоне. Она образуется при переходе электрона из 3 p в 3 s – состояние в пределах одного энергетического слоя.
Следующая линия этой серии излучается при переходе 4 p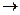 3 s. Ее длина волны l =330нм находится в УФ диапазоне. Граничная длина волны главной серии (линия при m = ¥)
3 s. Ее длина волны l =330нм находится в УФ диапазоне. Граничная длина волны главной серии (линия при m = ¥) 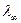 =241нм.
=241нм.
Большинство работ по спектроскопии было опубликовано на английском языке. Первой буквой p английского слова principal – главный - стали обозначать те подуровни, с которых переходит электрон при излучении линий этой серии.
Из-за спин-орбитального взаимодействия p – подуровень энергетически расщепляется на два. Поэтому спектральные лини главной серии представляют собой дублеты. Например, головная линия главной серии желтый дублет натрия состоит из двух линий с l 1 = 589,6 нм и l 2=589,0 нм.
Не только p – подуровень, но и другие более высокие d, f – подуровни энергетически расщеплены на два. Поэтому мультиплетное расщепление в спектрах щелочных металлов присутствует и в других сериях.
Исследование спектров многоэлектронных атомов показало, что постоянная Ридберга R несколько растет с увеличением номера элемента. Так, для водорода RH = 1,09678·107 м-1, для натрия RNa = 1,09735·107 м-1, а для наиболее тяжелых атомов RZ> 20 = 1,09737·107 м–1. Рост R происходит, в основном, в начале периодической таблицы, а уже с хлора Cl (Z = 17) рост R практически незаметен.
б. Резкая (sharp) серия возникает только в спектре излучения натрия при переходе электрона из s – состояния в p – состояние (рис.44). Формула резкой серии для натрия имеет вид: 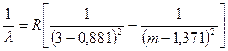 , m =4, 5, 6,… (7.8)
, m =4, 5, 6,… (7.8)
Из-за расщепления на две компоненты p –подуровня линии резкой серии также представляют собой дублеты. Головной дублет серии (m = 4) лежит в ИК – области, l 1 = 1140 нм и l 2 = 1138 нм (переход 4 s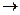 3 p). Дублет перехода 5 s
3 p). Дублет перехода 5 s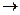 3 p 616 и 615 нм попадает в видимый диапазон. Переходу 6 s
3 p 616 и 615 нм попадает в видимый диапазон. Переходу 6 s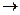 3 p соответствует линия 515 нм (расщепление D l менее 1 нм). Граничная длина волны резкой серии
3 p соответствует линия 515 нм (расщепление D l менее 1 нм). Граничная длина волны резкой серии 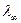 = 408 нм. Поэтому за исключением головной линии вся резкая серия находится в видимом диапазоне.
= 408 нм. Поэтому за исключением головной линии вся резкая серия находится в видимом диапазоне.
Как следует из названия, линии резкой серии контрастны. Это объясняется тем, что электроны при испускании этой серии переходят из s – состояний, не имеющих энергетического расщепления. Поскольку электроны попадают на две компоненты p –подуровня, то энергия излученных фотонов в дублетах резкой серии имеет одинаковую разность h ·D n для всей серии. Разница по частоте D n между компонентами дублета постоянна. Выраженная в длинах волн разность D l быстро убывает при смещении к фиолетовому концу серии.
в. Диффузная (diffuse) серия существует только в спектре излучения и возникает при переходах электрона на двойной 3 p –подуровень также с двойных вышележащих d – подуровней (рис.44). Правила отбора допускают реализацию только трех из четырех вариантов перехода. Поэтому каждая линия серии представляет собой триплет. Энергетические расстояния между компонентами d – подуровней много меньше по сравнению с расстоянием 3 p –подуровня. Из-за этого в спектральных аппаратах недостаточной разрешающей силы компоненты триплета не разрешаются, а весь триплет воспринимается как одна размытая (диффузная) линия. Формула диффузной серии для натрия имеет вид:
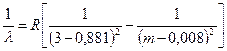 , m = 3, 4, 5,… (7.9)
, m = 3, 4, 5,… (7.9)
Головная линия этой серии (m = 3) имеет длину l = 818 нм и находится в ближнем ИК-диапазоне. Она излучается при переходах электрона 3 d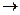 3 p в пределах одного энергетического слоя. С ростом номера m линии излучаются в видимом диапазоне, l (m = 4) = 586 нм, l (m = 5) = 498 нм. Граничная длина волны, как и в резкой серии, l (m = ¥) = 408 нм. За исключением головных линий обе серии – резкая и диффузная – находятся в видимом диапазоне.
3 p в пределах одного энергетического слоя. С ростом номера m линии излучаются в видимом диапазоне, l (m = 4) = 586 нм, l (m = 5) = 498 нм. Граничная длина волны, как и в резкой серии, l (m = ¥) = 408 нм. За исключением головных линий обе серии – резкая и диффузная – находятся в видимом диапазоне.
г. Основная (fundamental), фундаментальная серия названа так потому, что ее формула имеет минимальные отличия от формулы Бальмера. Для натрия
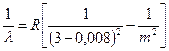 , m = 4,5,6,… (7.10)
, m = 4,5,6,… (7.10)
Она возникает при переходах электрона из f – состояний в 3 d – состояние. Все линии этой серии находятся в ИК-диапазоне. Головная линия (4 f 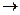 3 d) имеет длину l = 1846 нм, следующая (5 f
3 d) имеет длину l = 1846 нм, следующая (5 f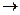 3 d) l = 1268 нм, граничная линия (m = ¥) l = 813 нм. Основная серия в спектре натрия очень похожа на серию Пашена в спектре водорода (1875 – 820 нм).
3 d) l = 1268 нм, граничная линия (m = ¥) l = 813 нм. Основная серия в спектре натрия очень похожа на серию Пашена в спектре водорода (1875 – 820 нм).
Поправочные коэффициенты a и b в формулах серий (7.6) уменьшаются по мере роста энергии уровней. Так, уровень 3 s имеет поправку 1,371, уровень 3 p – поправку 0,881, уровень 3 d – поправку 0,008. Отсюда можно сделать вывод, что чем ниже находится энергетический уровень в атоме щелочного металла, чем он ближе к оболочке инертного газа, тем сильнее деформировано электрическое поле ядра, тем больше отличается оно от кулоновского поля атома водорода. Фундаментальная серия потому так похожа на серию Пашена в спектре атома водорода, что уровни d и f находятся далеко от остова атома щелочного металла.
3. Естественная ширина спектральных линий. Испускание фотона в обычных условиях происходит при спонтанном (самопроизвольном) переходе атома из возбужденного, то есть энергетически более высокого, в энергетически низкое состояние. Время t, за которое число атомов, находящихся в данном возбужденном состоянии, уменьшается в е раз, называется временем жизни возбужденного состояния. В большинстве случаев t»10-8 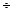 10-9 с. И лишь в метастабильных состояниях (аномально долгоживущих) время t может быть 10-1 с.
10-9 с. И лишь в метастабильных состояниях (аномально долгоживущих) время t может быть 10-1 с.
Возможность спонтанных переходов указывает на то, что возбужденные состояния нельзя считать строго стационарными. Энергия возбужденного состояния не является точно определенной. Из соотношения неопределенности Гейзенберга для энергии и времени (3.3) следует, что неопределенность энергии D E атома в возбужденном состоянии обратно пропорциональна времени t: 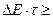 ħ,
ħ, 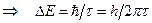 . (7.11)
. (7.11)
Неопределенность энергии возбужденного атома приводит к разбросу энергий испускаемых им фотонов. 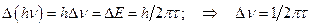 . (7.12)
. (7.12)
Перейдем от интервала частот D n к интервалу длин волн D l. Так как
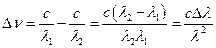 , то
, то 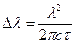 . (7.13)
. (7.13)
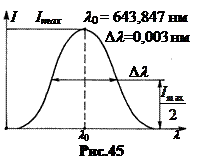
Для головной линии серии Бальмера (l = 656,3 нм, t = 10-8 с) эта ширина составляет D l = 2,3·10-5 нм. Современные спектральные аппараты позволяют измерять эту естественную ширину спектральных линий.
Если изобразить на графике зависимость интенсивности света I от длины волны l, то получается симметричная колоколообразная кривая. На рис.45 такая кривая показана для красной линии кадмия Cd с длиной волны l = 643,8 нм. Таких действительно простых линий в огромном множестве спектров очень мало. Даже у тех линий, которые в схеме тонкой структуры считаются простыми (спин – орбитальное взаимодействие), с повышением разрешения обнаруживается мультиплетность.
4. Сверхтонкая структура спектра. Такая дополнительная сверхтонкая структура может возникать по двум причинам.
Во-первых, из-за смешанного изотопного состава излучающих атомов. Например, природный водород состоит из смеси двух изотопов – протия 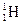 и дейтерия
и дейтерия 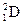 - в соотношении 5000: 1. Спектральные линии дейтерия чуть смещены в область более коротких длин волн. В обычной смеси линии дейтерия незаметны. Но если концентрацию дейтерия в газе повысить, то каждая линия, например, в серии Бальмера, распадется на две. Это изотопическая мультиплетность.
- в соотношении 5000: 1. Спектральные линии дейтерия чуть смещены в область более коротких длин волн. В обычной смеси линии дейтерия незаметны. Но если концентрацию дейтерия в газе повысить, то каждая линия, например, в серии Бальмера, распадется на две. Это изотопическая мультиплетность.
Во-вторых, из-за наличия у атомного ядра механического и магнитного моментов. Магнитный момент ядер примерно в 1000 раз меньше орбитального магнитного момента электронов. Но, тем не менее, взаимодействие спин-орбитальных моментов электронов с магнитным моментом ядра приводит к мультиплетности, которая регистрируется спектральными аппаратами высокой разрешающей силы. Например, зеленая линия ртути Hg с длиной волны l = 546,0724 нм кроме основной линии имеет сверхтонкую структуру из шести линий, -0,0236, -0,0102, -0,0069, l = 546,0724 нм, +0,0085, +0,0128, +0,0214 нм.
5. Доплеровское уширение спектральных линий. Поступательное движение излучающих атомов, обусловленное их тепловым движением, приводит к дополнительному уширению спектральных линий.
Частота света, излучаемая приближающимся к приемнику атомом, из-за эффекта Доплера несколько больше и равна n 0+D n. Частота света от удаляющегося атома несколько меньше и равна n 0 - D n. Здесь n 0 – частота света, излучаемого неподвижным атомом. В результате одна и та же спектральная линия за счет поступательного движения атомов уширяется до полосы частот (n 0+D n) – (n 0 - D n) = 2D n.
Из оптической формулы продольного эффекта Доплера (Оптика, ф. 28.10) следует, что
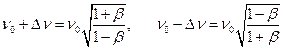 , где
, где 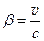 . (7.14)
. (7.14)
Отсюда, 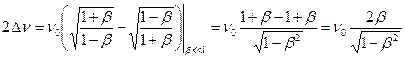 . (7.15)
. (7.15)
Относительное доплеровское уширение 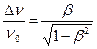 . (7.16)
. (7.16)
При комнатной температуре скорость теплового движения атомов водорода v = 2·103 м ç с. Отсюда 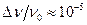 .
.
Доплеровское уширение проявляется уже в 5-6 знаке частоты n или длины волны l. Современные спектральные аппараты позволяют измерять n или l до 7-8 знаков. Поэтому тепловое уширение спектральных линий хорошо заметный и часто нежелательный эффект. Для его устранения нужно применять такие методы возбуждения атомов, которые могут реализоваться при низких температурах. Например, люминесценцию (см.§10).
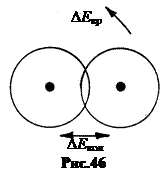 6. Молекулярные спектры. Объединение атомов в молекулу приводит к тому, что наряду с энергией электронного движения в атомах молекула, как сложная система, обладает энергией колебательного и вращательного движений (рис.46). По порядку величины квантовые энергетические ступени располагаются чаще всего так: D E эл>D E кол>D E вр. Здесь D E – ступени электронных энергетических уровней в атоме.
6. Молекулярные спектры. Объединение атомов в молекулу приводит к тому, что наряду с энергией электронного движения в атомах молекула, как сложная система, обладает энергией колебательного и вращательного движений (рис.46). По порядку величины квантовые энергетические ступени располагаются чаще всего так: D E эл>D E кол>D E вр. Здесь D E – ступени электронных энергетических уровней в атоме.
Наиболее существенное влияние на испускаемый молекулой спектр оказывает колебательное движение. Поскольку энергия внутримолекулярного колебательного движения квантована, то в любом объеме газа имеются группы молекул с одинаковыми значениями энергии колебаний D E кол 1, D E кол 2, D E кол 3 и т.д. В результате одному и тому же электронному переходу в атоме разным группам молекул соответствуют фотоны с разными частотами n 1, n 2, n 3,… так как при излучении фотона к энергии электронного перехода может добавляться энергия колебания молекулы.
Если вещество в атомарном состоянии, например, водород H, испускает линию с частотой n, то эта линия, испускаемая веществом в молекулярном состоянии (H2), расщепляется на систему линий в зависимости от числа энергетических ступеней колебания молекул.
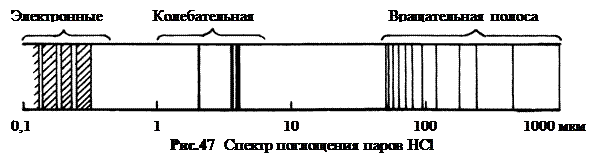
Расщепление линий кроме колебательного обусловлено еще и вращательным движением молекул. В результате спектры испускания молекул содержат группы с большим числом линий – полосы и потому называются полосатыми (рис.47).
 |
Если молекула ассиметрична и является электрическим диполем, например, H2O, CO2, то изменение ее колебательного уровня приводит к излучению или поглощению кванта электромагнитной энергии в ИК области спектра даже без электронного перехода. Наличие вращательного движения приводит к расщеплению и этого ИК спектра на ряд полос. Поэтому газы с дипольными молекулами в соответствии со своими спектрами испускания хорошо поглощают ИК лучи.
7. Парниковый эффект. На рис.48 вверху показан спектр поглощения водяных паров. Широкие полосы поглощения находятся в ИК диапазоне с l > 1000 нм.
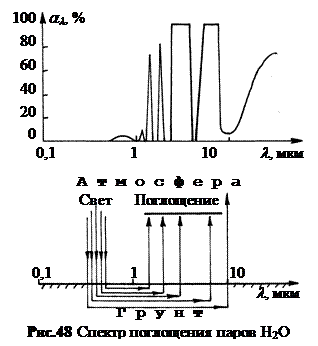 Максимум интенсивности солнечных лучей, падающих на землю, приходится на длину волны около 500 нм. В области длин волн от 200 до 1000 нм атмосфера имеет окно прозрачности. Основные атмосферные газы – азот и кислород, а также водяные пары слабо поглощают свет в этом диапазоне. Поэтому солнечные лучи при безоблачной погоде почти без потерь доходят до поверхности Земли (рис.48 внизу).
Максимум интенсивности солнечных лучей, падающих на землю, приходится на длину волны около 500 нм. В области длин волн от 200 до 1000 нм атмосфера имеет окно прозрачности. Основные атмосферные газы – азот и кислород, а также водяные пары слабо поглощают свет в этом диапазоне. Поэтому солнечные лучи при безоблачной погоде почти без потерь доходят до поверхности Земли (рис.48 внизу).
Если поверхность Земли не покрыта снегом, то коэффициент поглощения составляет около 80%. Энергия поглощенного света превращается в энергию теплового движения атомов и молекул поверхности. В результате дневная температура поверхности Земли повышается. Нагретая поверхность, в свою очередь, излучает электромагнитные волны в ИК диапазоне. Если принять температуру поверхности 310 К, то в соответствии с законом смещения Вина l max· T = b = 2,897·10-3 м·К максимум интенсивности излучения приходится на длину волны l max » 9 мкм. Поглощение водяными парами в этом диапазоне очень велико. Поэтому сквозь атмосферу проходит малая доля излучения с поверхности Земли. Основная часть энергии остается в нижних слоях атмосферы, где много водяных паров. Поэтому воздух в нижних слоях разогревается. Эта особенность водяных паров способствует созданию в атмосфере Земли парникового эффекта. Углекислый газ CO2 также имеет широкие полосы поглощения в ИК области. Рост его содержания в атмосфере усиливает парниковый эффект.
 2014-02-02
2014-02-02 6290
6290








