1. Периодическая система. В 1869 г. Дмитрий Менделеев открыл, что свойства химических элементов изменяются периодически с ростом атомной массы элементов.
В 1922 г. Нильс Бор на основе созданной им теории строения атома показал, что в основе систематики элементов лежит не атомная масса, а электрический заряд ядра. Если e – элементарный заряд, то заряд ядра можно представить как Ze, где Z – число элементарных зарядов в ядре, равное порядковому номеру элемента. Поскольку атом в нормальном состоянии нейтрален, то в его электронной оболочке содержится Z электронов.
2. Заполнение периодической таблицы – это мысленный процесс построения моделей многоэлектронных атомов на основе законов квантовой механики. В основе заполнения лежат три принципа.
а. Водородоподобность электронных конфигураций многоэлектронных атомов, Н. Бор, 1922 г. Заполнение ведется с наиболее низких по энергии уровней в направлении возрастания энергии. В первую очередь реализуются те конфигурации электронных облаков, в которых энергия связи электронов с ядром максимальна.
б. Принцип запрета Паули, 1925 г. В атоме нет двух и более электронов, находящихся в одинаковом состоянии, т.е. имеющих одинаковые наборы 4 квантовых чисел n, l, m, s.
Позднее выяснилось, что принцип запрета Паули справедлив для всех микрочастиц с полуцелым спином. Такие частицы называют фермионами.
в. Правило Хунда (Фридрих Хунд, 1927 г.). На подуровнях с одинаковой энергией электроны остаются по возможности неспаренными.
3. Первый период таблицы Менделеева, n =1. В соответствии с принципом запрета Паули на первом энергетическом уровне (в К – слое, в К - оболочке) может находиться не более 2 n 2 =2 электронов. Поэтому первый период таблицы составляют только два химических элемента – водород и гелий.
Водород Н. Номер Z = 1, заряд ядра Ze = e, в электронной оболочке находится один электрон в 1 s – состоянии. Механический L и магнитный М орбитальные моменты электрона равны нулю, L = 0, М = 0. Проекции спиновых моментов электрона Lsz = ħç 2, Мsz = eħç 2 me. Электронная формула водорода 1 s 1. Отдавая электрон в химических реакциях, атом водорода ведет себя как металл с валентностью N = 1. Потенциал ионизации атома Н равен 13,54 В.
Гелий Не. Поскольку заряд ядра Z входит лишь в радиальную часть решения уравнения Шредингера (5.1), то увеличение заряда ядра, влияя на размеры электронных облаков (уменьшает их), не сказывается на их конфигурации и расположении. Поэтому второй 1 s -электрон «идет» в атоме гелия в то же центрально-симметричное облако, в котором уже находиться 1 s -электрон водорода. Чтобы выполнялся принцип запрета Паули, спины электронов должны быть ориентированы в противоположных направлениях. Поэтому сумма проекций спиновых моментов атома гелия обращается в нуль. В результате все суммарные моменты атома гелия – орбитальные и спиновые – равны нулю.
К – слой заполнен полностью. Электронная оболочка гелия чрезвычайно устойчива. Потенциал ионизации гелия самый большой среди элементов и составляет 24,45 В. Поэтому гелий – инертный газ. Электронная конфигурация (формула) гелия 1 s 2. Двойка справа от s показывает число электронов, находящихся в 1 s -состоянии. Читается формула «один эс два».
4. Второй период, n = 2. На втором энергетическом уровне (в L -слое) может находиться не более 2 n 2 = 2·22 = 8 электронов. Это значит, что во второй период таблицы Менделеева входят элементы с номерами Z от 3 (литий Li) до 10 (неон Ne).
Литий Li. Номер Z = 3. С увеличением заряда ядра до 3 е третий электрон «идет» в L – слой в 2 s – состояние. Поскольку все моменты 1 s 2 оболочки гелия равны нулю, то моменты атома лития определяются исключительно третьим электроном. Так как он находится в 2 s – состоянии, то его орбитальные моменты также равны нулю. Остаются только спиновые. Для атома лития в целом L = 0, М = 0, Lsz = ħç 2, Мsz = eħç 2 me . Формула лития 1 s 22 s 1.
Третий электрон лития находиться в поле ядра, экранированного двумя электронами К – слоя. Поэтому он слабо связан с ядром. Потенциал ионизации атома лития равен 5,37 В.
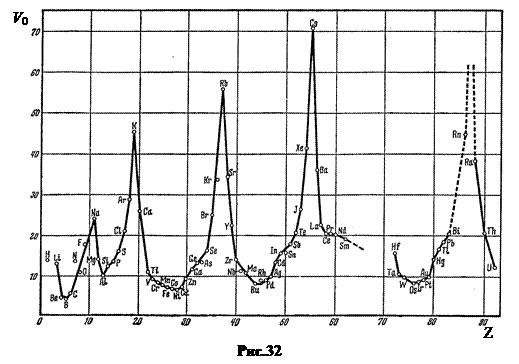 Меньше его лишь потенциалы ионизации других щелочных металлов – натрия, калия, рубидия, цезия. При внешнем воздействии третий электрон легко отрывается, поэтому атом лития легко окисляется с валентностью N = 1. Объемы атомов щелочных металлов самые большие. Это хорошо видно на рис.32, где по вертикальной оси отложены объемы V 0 в см3 ç моль для разных элементов.
Меньше его лишь потенциалы ионизации других щелочных металлов – натрия, калия, рубидия, цезия. При внешнем воздействии третий электрон легко отрывается, поэтому атом лития легко окисляется с валентностью N = 1. Объемы атомов щелочных металлов самые большие. Это хорошо видно на рис.32, где по вертикальной оси отложены объемы V 0 в см3 ç моль для разных элементов.
Бериллий Ве, Z = 4. В L – слое находятся два электрона с противоположными спинами в 2 s – состоянии. Часто на схемах размещение электронов в электронных оболочках атомов изображают с помощью квантовых ячеек, как показано на рис.33.
Формула бериллия 1 s 22 s 2. Все электроны спарены и находятся в s – состоянии. Поэтому все моменты атома равны нулю. За счет того, что внешние электроны в L – слое спарены (спины противоположны), по сравнению с литием потенциал ионизации атомов бериллия больше и равен 9,48 В. В химических реакциях бериллий менее активен, способен окисляться (отдавать электроны) с валентностью N = 2.
Бор В, Z = 5. С ростом числа электронов в атоме ядро атома все более экранируется электронной оболочкой. Поэтому для каждого последующего электрона поле ядра все больше отличается от кулоновского. Энергетические уровни в многоэлектронных атомах в отличие от атома водорода расщепляются. В значительной степени это происходит за счет кинетической энергии, связанной с ростом орбитального механического момента электронов.
Так, в L – слое (n = 2) орбитальные моменты электронов в 2 s – состоянии равны нулю. А в 2 р – состоянии орбитальный механический момент электрона 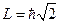 (4.22). Так как L = mevr, то mev = Lçr. Отсюда приращение энергии E = (mev)2 ç 2 me = L 2 ç 2 mer 2 = ħ 2 çmer 2. (6.1)
(4.22). Так как L = mevr, то mev = Lçr. Отсюда приращение энергии E = (mev)2 ç 2 me = L 2 ç 2 mer 2 = ħ 2 çmer 2. (6.1)
 В результате 2 р – подуровень в L – слое энергетически оказывается выше 2 s – подуровня в том же слое. Поэтому вначале заполняется 2 s – состояние и лишь затем 2 р – состояние (рис.34).
В результате 2 р – подуровень в L – слое энергетически оказывается выше 2 s – подуровня в том же слое. Поэтому вначале заполняется 2 s – состояние и лишь затем 2 р – состояние (рис.34).
Моменты атома бора определяются моментами одного наружного 2 р – электрона. Хотя потенциал ионизации бора несколько меньше по сравнению с бериллием и равен 8,4 В, металлические свойства бора выражены слабее. Его валентность N = 3. Формула бора 1 s 22 s 22 p 1.
От Бора до Неона (B ® Ne) идет последовательное заполнение 2 р – подуровня. В соответствии с правилом Хунда 6-ой электрон в атоме углерода идет во вторую квантовую ячейку (орбиталь). Поэтому углерод может быть 2-х и 4-х валентен (рис.35, вверху).
По мере заполнения 2 р – подуровня потенциалы ионизации атома растут, атомы в химических реакциях все более способны присоединять электроны, чем их отдавать (рис.35).
 На неоне (Z = 10) заканчивается заполнение L – слоя. Как и у гелия, полностью заполненный L – слой образует очень устойчивую электронную оболочку. Все моменты оболочки неона (1 s 22 s 22 p 6) равны нулю. Потенциал ионизации 21,5 В. Поэтому, как и гелий, неон – инертный газ.
На неоне (Z = 10) заканчивается заполнение L – слоя. Как и у гелия, полностью заполненный L – слой образует очень устойчивую электронную оболочку. Все моменты оболочки неона (1 s 22 s 22 p 6) равны нулю. Потенциал ионизации 21,5 В. Поэтому, как и гелий, неон – инертный газ.
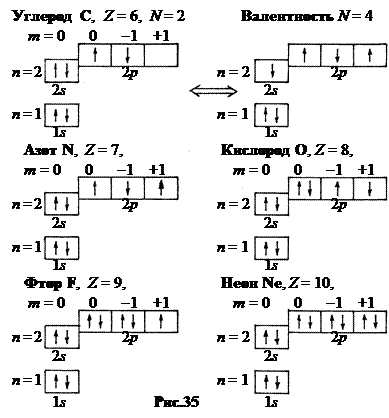
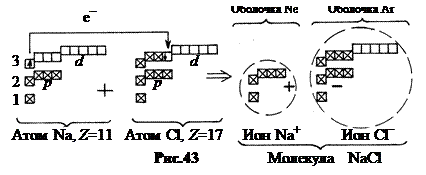
 5. Третий период, n = 3. Как и второй он начинается со щелочного металла. Натрий Na, Z = 11, сходен по своим свойствам с литием Li. Его одиннадцатый электрон размещается далеко от ядра в М – слое (n = 3) в 3 s – состоянии. Объем атома самый большой среди элементов третьего периода (рис.32). Потенциал ионизации всего лишь 2,12 В. После натрия вплоть до аргона Ar (Z = 18) подуровни заполняются в соответствии с теоретической схемой. Свойства элементов в третьем периоде изменяются так же, как и во втором, от типичного металла (Na) до типичного неметалла хлора (Cl, Z = 17).
5. Третий период, n = 3. Как и второй он начинается со щелочного металла. Натрий Na, Z = 11, сходен по своим свойствам с литием Li. Его одиннадцатый электрон размещается далеко от ядра в М – слое (n = 3) в 3 s – состоянии. Объем атома самый большой среди элементов третьего периода (рис.32). Потенциал ионизации всего лишь 2,12 В. После натрия вплоть до аргона Ar (Z = 18) подуровни заполняются в соответствии с теоретической схемой. Свойства элементов в третьем периоде изменяются так же, как и во втором, от типичного металла (Na) до типичного неметалла хлора (Cl, Z = 17).
Теоретически аргон не завершает третий период. Ведь в М – слое должны находиться 2 n 2 = 2×32 = 18 электронов. А аргону – восьмому элементу в периоде соответствует всего лишь восьмой электрон в М -слое.
Если бы заполнение М – слоя шло далее в соответствии с теоретической схемой, то аргон оказался бы примерно в середине третьего периода (рис.36).
Для завершения М – слоя нужно еще 10 электронов на 3 d – подуровень. Однако опыт в химии и спектроскопии показывает, что 19-й электрон «идет» не в 3 d – состояние, а в 4 s, давая тем самым начало новому периоду.
Первые три периода называются малыми. Элементы, расположенные друг над другом, сходны по своим свойствам и образуют группы элементов. Первая слева группа (H, Li, Na) – группа щелочных металлов. Все ее элементы содержат во внешнем слое один электрон в s – состоянии. Элементы второй группы (Be, Mg) содержат по два электрона в s – состоянии, элементы третьей группы (B, Al) содержат по три электрона в s – и p – состоянии и т.д. Периодическое изменение числа электронов во внешнем слое и определяет? в основном, периодичность свойств элементов в периодах.
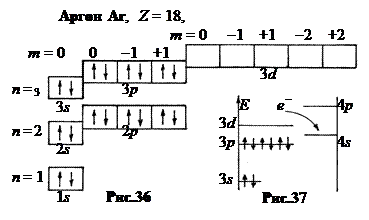
6. Четвертый период, n = 4. Расщепление энергетических уровней в многоэлектронных атомах с ростом номера слоя n оказывается столь значительным, что подуровни разных слоев начинают перекрываться. В результате нижний s – подуровень 4-го слоя оказывается ниже верхнего d – подуровня 3-го слоя (рис.37). Поэтому 19-му и 20-му электронам энергетически «выгоднее» разместиться не на 3 d, а на 4 s – подуровне. Получаются элементы калий К (Z = 19) и кальций Са (Z = 20) – типичные металлы с низкими потенциалами ионизации 4,32 и 6,09 В.
 |
Лишь после этого заполняется 3 d -подуровень (10 электронов) со скандия Sc (Z = 21) до цинка Zn (Z = 30). Поскольку заполнение подуровней идет в глубине электронной оболочки, изменение свойств элементов менее выражено. Свойства этих элементов уже не соответствуют свойствам выше расположенных элементов предыдущих периодов. Чтобы спасти положение, Менделеев разделил вертикальные столбцы-группы элементов на подгруппы. Главную подгруппу образуют элементы, начинающиеся с элементов малых периодов. Главная подгруппа щелочных металлов, главная подгруппа галогенов и др. В атомах элементов главных подгрупп на внешнем слое одинаковое число электронов.
 Побочные подгруппы образуют элементы, заполнение слоев которых идет в глубине. Менделеев предложил разделять подгруппы, сдвигая символ элемента в клетке периодической таблицы к левой или правой стороне (рис.38 на странице 32).
Побочные подгруппы образуют элементы, заполнение слоев которых идет в глубине. Менделеев предложил разделять подгруппы, сдвигая символ элемента в клетке периодической таблицы к левой или правой стороне (рис.38 на странице 32).
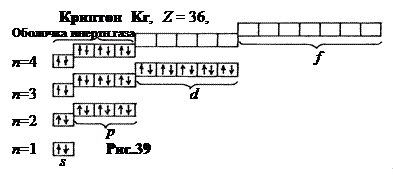
Начиная с галлия (Ga, Z = 31) продолжается заполнение 4-го слоя (4 p -состояние). Когда вновь образуется устойчивая конфигурация 4 s 24 p 6 (инертный газ) криптон (Kr, Z = 36), заполнение 4-го слоя прекращается.
Всего в 4-м слое должно быть 2 n 2 = 2·42 = 32 электрона. Но элементов в 4-м периоде только 18. Из них 10 образованы заполнением предыдущего 3 d -подуровня. Незаполненными в N -слое остались 4 d и 4 f - подуровни (рис.39).
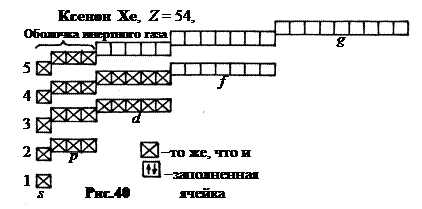 7. Пятый период, n = 5. Из-за перекрытия энергетических уровней 37-й и 38-й электроны “идут” в 5 s -состояние. Образуются типичные металлы рубидий Rb (Z = 37) и стронций Sr(Z = 38) с потенциалами ионизации 4,16 и 5,67 В. В 10 элементах, с 39 (иттрий Y) по 48 (кадмий Cd) идет заполнение 4 d -подуровня. С 49 (индий In) по 54 (ксенон Xe) идет заполнение 5 p -подуровня. В атоме ксенона с устойчивой конфигурацией внешней оболочки 5 s 25 p 6 остаются незаполненными не только подуровни 5-го слоя 5 d, 5 f и 5 g, но и подуровень 4 f 4-го слоя (рис.40).
7. Пятый период, n = 5. Из-за перекрытия энергетических уровней 37-й и 38-й электроны “идут” в 5 s -состояние. Образуются типичные металлы рубидий Rb (Z = 37) и стронций Sr(Z = 38) с потенциалами ионизации 4,16 и 5,67 В. В 10 элементах, с 39 (иттрий Y) по 48 (кадмий Cd) идет заполнение 4 d -подуровня. С 49 (индий In) по 54 (ксенон Xe) идет заполнение 5 p -подуровня. В атоме ксенона с устойчивой конфигурацией внешней оболочки 5 s 25 p 6 остаются незаполненными не только подуровни 5-го слоя 5 d, 5 f и 5 g, но и подуровень 4 f 4-го слоя (рис.40).
В 5-м слое должны находиться 2 n 2 = 2·52 = 50 электронов. Но элементов в 5-периоде таблицы Менделеева только 18. Из них 8 принадлежат 5-му периоду “на законных основаниях”, так как образованы заполнением 5 s и 5 p подуровней, а 10 образованы заполнением 4 d -подуровня.
8. Шестой период, n = 6. Здесь еще более сложное положение. После ксенона 55-й и 56-й электроны идут на 6 s -подуровень, в результате образуются металлы цезий (Cs, Z = 55)и барий (Ba, Z = 56). В атоме лантана 57-й электрон идет в 5 d -состояние, а у последующих 14 элементов (церий Се, Z = 58-лютеций Lu, Z = 71) электроны идут еще глубже, заполняя 4 f -состояние. Поскольку электроны идут в глубину оболочки, изменение свойств элементов проявляется очень слабо. Вся эта группа элементов, начиная с лантана, называется группой лантаноидов и сводится в отдельную строку периодической таблицы.
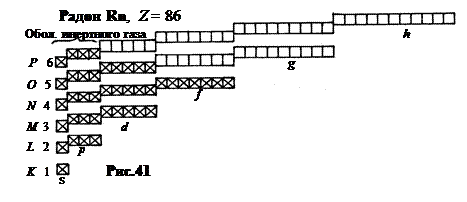 После лантаноидов, начиная с гафния (Hf, Z = 72), продолжается заполнение предпоследнего слоя в 5 d -состоянии (Первый электрон в 5 d -состоянии у лантана, Z = 57, второй - у гафния, Z = 72, и далее до ртути Hg, Z = 80). От таллия Tl (Z = 81) до радона Rn (Z = 86) заполняется 6 p -подуровень, кончающийся устойчивой оболочкой инертного газа радона с конфигурацией 6-го слоя 6 s 26 p 6 (рис.41).
После лантаноидов, начиная с гафния (Hf, Z = 72), продолжается заполнение предпоследнего слоя в 5 d -состоянии (Первый электрон в 5 d -состоянии у лантана, Z = 57, второй - у гафния, Z = 72, и далее до ртути Hg, Z = 80). От таллия Tl (Z = 81) до радона Rn (Z = 86) заполняется 6 p -подуровень, кончающийся устойчивой оболочкой инертного газа радона с конфигурацией 6-го слоя 6 s 26 p 6 (рис.41).
9. Седьмой период, n = 7 завершает таблицу известных элементов. У франция Fr (Z = 87) и радия Ra (Z = 88) заполняется 7 s -подуровень, а начиная с актиния Ас (Z = 89) образуется группа из 14 элементов – актиноидов, в которых заполняется более глубокий 5 f -подуровень. Элементы, имеющиеся в природе, заканчиваются ураном U (Z = 92). Все элементы, находящиеся дальше урана (Z ³ 93), называются трансурановыми элементами.Все они радиоактивны и имеют период полураспада, который много меньше времени существования Земли. Поэтому в земной коре их нет (все распались). Некоторые трансурановые элементы, примерно до Z = 112, удалось получить искусственно с помощью ядерных реакций. Однако элемента с оболочкой инертного газа пока среди них нет.
10. Химическая связь. Впервые теоретически исследовали условия коллективизации двух атомов водорода в молекулу Вальтер Гайтлер и Фриш Лондон в 1927 году. Полученные ими и другими исследователями результаты позволяют всё множество типов химических связей разделить на две группы: ковалентная связь и ионная связь.
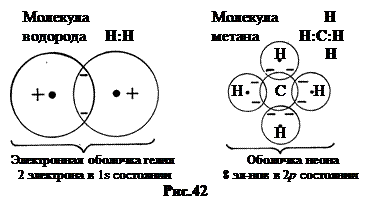 а. Ковалентная связь образуется между схожими по химическим свойствам элементами: H2, N2, O2, CN, CH4. При сближении атомов их внешние электроны могут переходить от одного атома к другому. Если спины электронов в перекрывающихся облаках противоположны, то энергия системы из двух атомов оказывается меньше, чем сумма энергий двух отдельных атомов. В результате атомы соединяются в молекулу, а внешние электроны коллективизируются. Они одинаково принадлежат обоим атомам. Внешние энергетические слои атомов насыщаются при этом до электронных оболочек инертных газов. Например, у молекулы водорода H2 получается оболочка гелия, у молекулы метана CH4 – оболочка неона (рис.42).
а. Ковалентная связь образуется между схожими по химическим свойствам элементами: H2, N2, O2, CN, CH4. При сближении атомов их внешние электроны могут переходить от одного атома к другому. Если спины электронов в перекрывающихся облаках противоположны, то энергия системы из двух атомов оказывается меньше, чем сумма энергий двух отдельных атомов. В результате атомы соединяются в молекулу, а внешние электроны коллективизируются. Они одинаково принадлежат обоим атомам. Внешние энергетические слои атомов насыщаются при этом до электронных оболочек инертных газов. Например, у молекулы водорода H2 получается оболочка гелия, у молекулы метана CH4 – оболочка неона (рис.42).
Если молекула образуется из одинаковых атомов (H2, O2, N2), то она симметрична, если из разных (CN) - асимметрична. В случае соударения атомов, внешние электроны которых имеют параллельные спины, энергия системы оказывается больше суммы энергий отдельных атомов. Между атомами возникает отталкивание, они расходятся. В целом, химически активными, то есть валентными электронами оказываются лишь те, которые не парны по спину. У водорода это один электрон в 1 s -состоянии, у лития – один электрон в 2 s -состоянии. У бериллия два внешних электрона в 2 s -состоянии спарены. Но при достаточной энергии возбуждения один электрон переходит 2 p -состояние, в результате получаются два неспаренных электрона.
|
Энергия, затрачиваемая на извлечение 3 s -электрона из атома Na и включение его в атом Cl, компенсируется энергией, которая выделяется при сближении пртивоположно заряженных ионов Na+ и Cl‑. В результате возникает устойчивая электростатическая система NaCl (рис.43).
 2014-02-02
2014-02-02 6646
6646
