Соединения серы (IV)
Токсичность сероводорода
Химические свойства сульфидов
Получение сульфидов
- Прямое взаимодействие простых веществ при нагревании в инертной атмосфере
Fe + S = FeS.
- Восстановление твердых солей оксокислот
BaSO4 + 4C = BaS + 4CO (при 1000°С)
SrSO3 + 2NH3 = SrS + N2 + 3H2O (при 800°С)
CaCO3 + H2S + H2 = CaS + CO + 2H2O (при 900°С)
- Малорастворимые сульфиды металлов осаждают из их растворов действием сероводорода или сульфида аммония
Mn(NO3)2 + H2S = MnS↓ + 2HNO3
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3
- Растворимые сульфиды в воде сильно гидролизованны, имеют щелочную среду:
Na2S + H2O = NaHS + NaOH;
S2- + H2O = HS- + OH-.
- Окисляются кислородом воздуха, в зависимости от условий возможно образование оксидов, сульфатов и металлов:
2CuS + 3O2 = 2CuO + 2SO2;
CaS + 2O2 = CaSO4;
Ag2S + O2 = 2Ag + SO2.
- Сульфиды, особенно растворимые в воде, являются сильными восстановителями:
2KMnO4 + 3K2S + 4H2O = 3S + 2MnO2 + 8KOH.
На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны его смеси с воздухом, содержащие от 4 до 45% Н2S. Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление. При вдыхании сероводорода в значительных концентрациях может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания (если пострадавший не был своевременно вынесен из отравленной атмосферы). Первым симптомом острого отравления служит потеря обоняния. В дальнейшем появляются головная боль, головокружение и тошнота. Иногда через некоторое время наступают внезапные обмороки. Противоядием служит, прежде всего, чистый воздух. Тяжело отравленным сероводородом дают вдыхать кислород. Иногда приходится применять искусственное дыхание. Хроническое отравление малыми количествами Н2S обусловливает общее ухудшение самочувствия, исхудание, появление головных болей и т.д. Предельно допустимой концентрацией Н2S в воздухе производственных помещений считается 0,01 мг/л.
Степень окисления +4 для серы является довольно устойчивой и проявляется в тетрагалогенидах SHal4, оксодигалогенидах SOHal2, диоксиде SO2 и в отвечающих им анионах. Мы познакомимся со свойствами диоксида серы и сернистой кислоты.
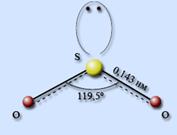 Строение молекулы SO2
Строение молекулы SO2
Строение молекулы SO2 аналогично строению молекулы озона. Атом серы находится в состоянии sp2-гибридизации, форма расположения орбиталей – правильный треугольник, форма молекулы – угловая. На атоме серы имеется неподеленная электронная пара. Длина связи S – O равна 0,143 нм, валентный угол составляет 119,5°.
Строение соответствует следующим резонансным структурам:
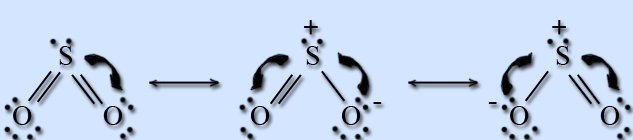
В отличие от озона, кратность связи S – O равна 2, то есть основной вклад вносит первая резонансная структура. Молекула отличается высокой термической устойчивостью.
 2014-02-02
2014-02-02 2166
2166








