Получение оксида серы (IV)
Химические свойства оксида серы (IV)
При обычных условиях диоксид серы или сернистый газ – бесцветный газ с резким удушливым запахом, температура плавления -75 °С, температура кипения -10 °С. Хорошо растворим в воде, при 20 °С в 1 объеме воды растворяется 40 объемов сернистого газа. Токсичный газ.
- Сернистый газ обладает высокой реакционной способностью. Диоксид серы – кислотный оксид. Он довольно хорошо растворим в воде с образованием гидратов. Также он частично взаимодействует с водой, образуя слабую сернистую кислоту, которая не выделена в индивидуальном виде:
SO2 + H2O = H2SO3 = H+ + HSO3- = 2H+ + SO32-.
В результате диссоциации образуются протоны, поэтому раствор имеет кислую среду.
- При пропускании газообразного диоксида серы через раствор гидроксида натрия образуется сульфит натрия. Сульфит натрия реагирует с избытком диоксида серы и образуется гидросульфит натрия:
2NaOH + SO2 = Na2SO3 + H2O;
Na2SO3+ SO2 = 2NaHSO3.
- Для сернистого газа характерна окислительно-восстановительная двойственность, например, он, проявляя восстановительные свойства, обесцвечивает бромную воду:
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
и раствор перманганата калия:
5SO2 + 2KMnO4 + 2H2O = 2KНSO4 + 2MnSO4 + H2SO4.
окисляется кислородом в серный ангидрид:
2SO2 + O2 = 2SO3.
Окислительные свойства проявляет при взаимодействии с сильными восстановителями, например:
SO2 + 2CO = S + 2CO2 (при 500 °С, в присутствии Al2O3);
SO2 + 2H2 = S + 2H2O.
- Сжигание серы на воздухе
S + O2 = SO2.
- Окисление сульфидов
4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
- Действие сильных кислот на сульфиты металлов
Na2SO3 + 2H2SO4 = 2NaHSO4 + H2O + SO2.
1.11.2. Сернистая кислота и её соли
При растворении диоксида серы в воде образуется слабая сернистая кислота, основная масса растворенного SO2 находится в виде гидратированной формы SO2·H2O, при охлаждении также выделяется кристаллогидрат, лишь небольшая часть молекул сернистой кислоты диссоциирует на сульфит- и гидросульфит-ионы. В свободном состоянии кислота не выделена.
Будучи двухосновной, образует два типа солей: средние – сульфиты и кислые – гидросульфиты. В воде растворяются лишь сульфиты щелочных металлов и гидросульфиты щелочных и щелочно-земельных металлов.
Сульфит-ион имеет строение тригональной пирамиды с атомом серы в вершине. Гибридизация серы sp3. На атоме серы имеется неподеленная электронная пара.
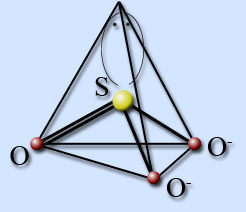
Гидросульфит-ион существует в виде двух изомерных форм. В изомере I атом водорода связан с атомом серы, а в изомере II – с атомом кислорода. При температуре 20 °С доля второй формы составляет 20 %.
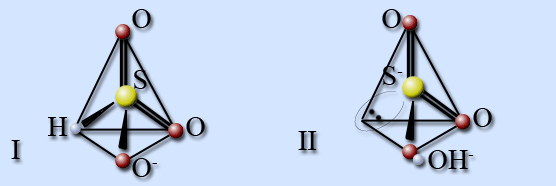
 2014-02-02
2014-02-02 5315
5315








