Соединения серы (VI)
Химические свойства сульфитов
- Растворимые сульфиты сильно гидролизуются:
Na2SO3 + H2O = NaHSO3 + NaOH;
SO32- + H2O = HSO3- + OH-.
- Сернистая кислота и её соли проявляют ярко выраженные восстановительные свойства:
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4;
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O.
- Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 = 2Na2SO4.
- Твердые сульфиты щелочных металлов при сильном нагревании диспропорционируют:
4Na2SO3 = 3Na2SO4 + Na2S (при 900°С);
а соли щелочноземельных металлов разлагаются при нагревании в вакууме до оксидов:
CaSO3 = CaO + SO2.
Степень окисления +6 для серы является довольно устойчивой и проявляется в соединениях с более электроотрицательными элементами: в гексафториде SF6, оксо- и диоксогалогенидах, оксиде и соответствующих им анионах. Мы познакомимся со свойствами триоксида серы и серной кислоты.
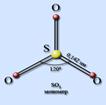 Строение молекулы SO3
Строение молекулы SO3
В газовой фазе триоксид серы существует в виде мономерных молекул. Атом серы находится в состоянии sp2-гибридизации, форма молекулы – правильный треугольник. Длина связи S – O равна 0,142 нм, валентный угол составляет 120°. Кратность связи S – O равна 2.
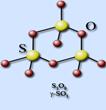 Твердый серный ангидрид образует несколько полиморфных модификаций. В льдоподобной γ-SO3 тетраэдры SO4 связаны общими вершинами в циклические тримеры S3O9, напоминающие циклические силикаты.
Твердый серный ангидрид образует несколько полиморфных модификаций. В льдоподобной γ-SO3 тетраэдры SO4 связаны общими вершинами в циклические тримеры S3O9, напоминающие циклические силикаты.
 2014-02-02
2014-02-02 2347
2347








