а) Расчет величины потенциала в начале титрования
Когда идет речь об окислительно-восстановительном потенциале, то имеется в виду не отдельный элемент или его ионы, а система, характеризующаяся определенным равновесием. Например:
| Fe3+ + e‑ ⇆ Fе2+ | (а) |
| Fe2+ + 2e‑ ⇆ Fе0 | (б) |
| Fe3+ + 3e‑ ⇆ Fе0 | (в) |
| [Fе(СN6)3+] +е‑⇆ [Fe(CN)6]4‑ | (г) |
| [FeF6]3‑ + e‑ ⇆ Fe2+ + 6F‑ | (д) |
Вследствие этого для систем, выражающих различное состояние данного элемента, может быть не одно, а несколько значений нормального потенциала. Так, для железа, в соответствии с уравнениями а, б, в, г, д существуют различные значения нормального потенциала.
При титровании солей железа (II) сульфатом церия (IV) ионы железа (II) окисляются до ионов железа (III), в результате возникает система, выражаемая следующим уравнением
Fe2+ ‑ e‑ ⇆ Fе3+
Если для титрования взято 100 мл 0,1 и. раствора соли железа (II), то при прибавлении первой капли (~0,001 мл) 0,1 и. стандартною раствора сульфата церия образуется эквивалентное количество Fe2+ -ионов. Поэтому в начале титрования отношение концентраций ионов [Fe3+]/[Fe2+], определяющее потенциал системы, можно считать равным:
| [Fe3+] | » | 0,001 | » 10-5 |
» 0,771 ‑ 0,059 × 5» 0,771 ‑ 0,295» 0,476 B
Реакция окисления железа (II) церием (IV) идет согласно уравнению:
Се4+ + Fe2+ = Се3+ + Fe3+
E °Fe3+/Fe2+ = 0,77l B, E °Ce4+/Ce3+ = 1,45 B
Реакция обратима, и во время титрования, после каждого прибавления стандартного раствора сульфата церия, устанавливается равновесие:
окислитель1 (Ce4+) + восстановитель2 (Fe2+) ⇆
⇆ восстановитель (Се3+) + окислиnель (Fe3+)
Окислительно-восстановительные потенциалы обеих систем
+ Fe3+ + е ⇆ Fe2+ Се4+ + е ⇆ Се3+
при установившемся равновесии равны друг другу. Поэтому расчет потенциала в каждый данный момент титрования после установления равновесия может быть сделан по одному из следующих уравнений:
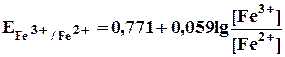

б) Расчет величины потенциала в процессе титрования до точки эквивалентности.
При приливании к 100 мл 0,1 н. раствора соли железа(II) 0,1 мл 0,1 н. раствора сульфата церия(IV) происходит окисление ионов Fe2+ в Fe3+ в количестве, эквивалентном его количеств содержащемуся в 0,1 мл 0,1 н. раствора. В этот момент, если не учитывать разбавление раствора, отношение:
| [Fe3+] | = | 0,1 | = 10-3 |
| [Fe2+] |
Следовательно:
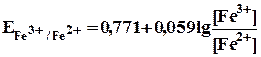 = 0,771 +0,059 lg 10-3 = 0,771 ‑0,059•3 = 0,594 B
= 0,771 +0,059 lg 10-3 = 0,771 ‑0,059•3 = 0,594 B
При приливании 1 мл стандартного раствора сульфата церия образуется эквивалентное количество ионов Fe3+ и
| [Fe3+] | = | = 10-2 | |
| [Fe2+] |
тогда
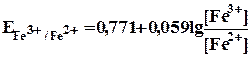 = 0,771 +0,059 lg 10-2 = 0,771 ‑0,059•2 = 0,653 B
= 0,771 +0,059 lg 10-2 = 0,771 ‑0,059•2 = 0,653 B
При приливании к 100 мл 0,1 н. раствора соли железа(II) 10 мл 0,1 н. раствора сульфата церия (IV)
| [Fe3+] | = | » 10-1 | |
| [Fe2+] |
Следовательно
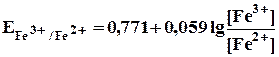 » 0,771 +0,059 lg 10-1» 0,771 ‑0,059» 0,712 B
» 0,771 +0,059 lg 10-1» 0,771 ‑0,059» 0,712 B
После добавления 50 мл раствора сульфата церия половина ионов железа (П) будет окислена и [Fe3+] = [Fe2+]; тогда
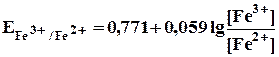 = 0,771 +0,059 lg 1 = 0,771 = 0,771 B
= 0,771 +0,059 lg 1 = 0,771 = 0,771 B
После прибавления 90 мл раствора сульфата церия неокисленными останутся ионы железа(П) в количестве, соответствующем 10 мл раствора:
| [Fe3+] | = | » 10 | |
| [Fe2+] |
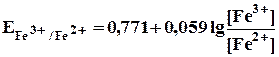 = 0,771 +0,059 lg 10 = 0,771 +0,059 = 0,830 B
= 0,771 +0,059 lg 10 = 0,771 +0,059 = 0,830 B
После прибавления 99 мл раствора сульфата церия:
| [Fe3+] | = | » 100 | |
| [Fe2+] |
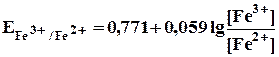 = 0,771 +0,059 lg 100 = 0,771 +0,059×2 =
= 0,771 +0,059 lg 100 = 0,771 +0,059×2 =
= 0,771 + 0,118 = 0,889 B
После прибавления 99,9 мл раствора сульфата церия:
| [Fe3+] | = | 99,9 | » 1000 |
| [Fe2+] | 0,1 |
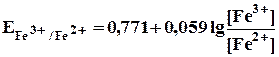 = 0,771 +0,059 lg 1000 = 0,771 +0,059×3 =
= 0,771 +0,059 lg 1000 = 0,771 +0,059×3 =
= 0,771 + 0,177 = 0,948 B
в) Расчет величины потенциала в точке эквивалентности
В точке эквивалентности, т.е.в момент, когда 100 мл 0,1 н раствора сульфата церия прибавлено к 100 мл 0,1 н раствора соли железа(П), в растворе устанавливается следующее равновесие
[Ce3+] = [Fe3+] [Ce4+] = [Fe2+]
или
| [Ce4+] | = | [Fe2+] |
| [Ce3+] | [Fe3+] |
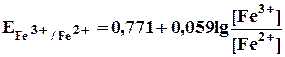

Для установившегося равновесия Е Се4+/Се3+.= Е Fе3+/Fе2+. = Е можно написать
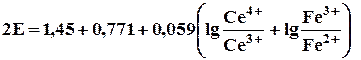
| 2Е = 1,45 + 0,771 + 0,059 lg | [Ce4+]×[Fe3+] |
| [Ce3+]×[Fe2+] |
Так как
| [Ce4+] | = | [Fe2+] |
| [Ce3+] | [Fe3+] |
то выражение под знаком логарифма равно единице:
2 Е = 1,45 + 0,771
| Е = | 1,45 + 0,771 | = 1,110 В |
Таким образом, в точке эквивалентности Е = 1,110 В
Для точки эквивалентности согласно формуле 6:
 [Восст.1] [Восст.1] | = | [Окисл.2] | =Ö К Окисл./Восст. |
| [Окисл.1] | [Восст.2] |
а согласно формуле 5:
| lg К Окисл./Восст.= | n(Ео1 ‑ Ео2) |
| 0,059 |
Для нашего случая титрования (n = 1)
| lg K Окисл./Восст. = | 1,45 ‑ 0,771 | = 11,5 |
| 0,059 |
K Окисл./Восст. » 4×1011
Поэтому в точке эквивалентности
 [Ce3+] [Ce3+] | = | [Fe3+] | =Ö4×1011» 6,4×105 |
| [Ce4+] | [Fe2+] |
Это означает, что реакция будет идти практически до конца слева направо и что в момент равновесия в точке эквивалентности [Fe2+] в титруемом растворе будет более чем в миллион раз меньше [Fe3+], т. е. ионы железа(П) будут практически полностью оттитрованы (окислены).
г) Расчет величины потенциала после точки эквивалентности.
Расчет производят, пользуясь уравнением:
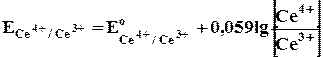
Нормальный потенциал этой системы E °Ce4+/Ce3+ равен 1,45 В. Прибавление избытка 0,1 мл 0,1 н раствора соли церия(IV) создает отношение
| [Ce4+] | = | 0,1 | = 10-3 |
| [Ce3+] |
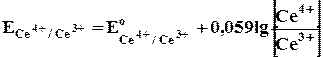 = 1,45 + 0,059 lg×10-3 =
= 1,45 + 0,059 lg×10-3 =
= 1,45 ‑ 0,059×3 = 1,273 В
Прибавление 1 мл 0,1 н раствора сульфата церия создает отношение:
| [Ce4+] | = | = 10-2 | |
| [Ce3+] |
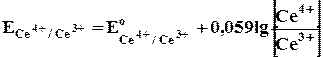 = 1,45 + 0,059 lg×10-2 =
= 1,45 + 0,059 lg×10-2 =
= 1,45 ‑ 0,059×2 = 1,332 В
Прибавление 10 мл 0,1 н раствора сульфата церия создает отношение:
| [Ce4+] | = | = 10-1 | |
| [Ce3+] |
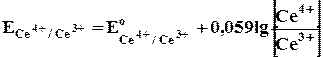 = 1,45 + 0,059 lg×10-1 =
= 1,45 + 0,059 lg×10-1 =
= 1,45 ‑ 0,059 = 1,391 В
Другими словами, в начальный период после достижения точки эквивалентности значение потенциала (подобно его значению в точке эквивалентности) продолжает резко повышаться при добавлении первых капель раствора сульфата церия, а затем значение потенциала изменяется в меньшей степени. Полученные данные расчетов приведены в табл. 4.2. При титровании применяют индикатор ферроин.
Таблица 4.2.
Титрование 100 мл, 0,1 н. раствора ионов железа(II) 0,1 н. раствором ионов церия (IV)
| Прибавлено 0,1 н. раствора сульфата церия, мл | Осталось ионовFe2+, % | Соотношение концентраций ионов | Значение потенциала, В | D E/ D C | |
| До точки эквивалентности [Fe3+] / [Fe2+] | |||||
| 1 капля ~0,001 мл | 0,001/100 = 10-5 | 0,476 | |||
| 0,1 | 99,9 | 0,1/99,9 = 10-3 | 0,594 | 0,118/0,1 = 1,18 | |
| 1/99 = 10-2 | 0,653 | 0,059/0,9 = 0,065 | |||
| 10/90=10-1 | 0,712 | 0,059/10 = 0,006 | |||
| 50/50 = 1 | 0,771 | 0,059/40 = 0,0015 | |||
| 90/10» 10 | 0,830 | 0,059/70 = 0,0015 | |||
| 99/1»102 | 0,889 | 0,059/9 = 0,0065 | |||
| 99,9 | 0,1 | 99,9/0,1» 103 | 0,948 | 0,059/0,9 = 0,065 | |
| В точке эквивалентности [Сe3+] = [Fe3+]; [Сe4+] = [Fe2+] | |||||
| [Сe3+]/[Сe4+] = [Fe3+]/[Fe2+] = = 6,4×105 | 0,771+1,45 =1,110 | 0,162/0,1 =1,62 | |||
| После точки эквивалентности [Сe4+]/[Сe3+] избыток ионов церия(IV) | |||||
| 100,1 | 0,1 | 0,1/100,1» 10-3 | 1,273 | 0,163/0,1 = 1,63 | |
| 101,0 | 1/101,0» 10-2 | 1,332 | 0,059/0,9 = 0,065 | ||
| 10/110» 10-1 | 1,391 | 0,059/9 = 0,0065 | |||
Построение кривых титрования. Если на оси абсцисс откладывать содержание (в процентах) остающегося в растворе (в разные моменты титрования) восстановителя или окислителя или количество прибавленного стандартного раствора (в миллилитрах), а на оси ординат — отвечающие им значения Е (в милливольтах), то можно построить кривую, представляющую ход изменения Е в процессе окисления—восстановления.
На рис. 4.1. показана наиболее характерная часть кривой титрования 0,1 н. раствора сульфата железа(II) 0,1 н. раствором сульфата церия(IV) (10% остатка Fe2+-ионов и 10% избытка стандартного раствора Се(SО4)2]. Как видно из рис. 4.1., кривая окислительно-восстановительного титрования напоминает кривые, получаемые в методе нейтрализации. В начале титрования, когда в титруемом растворе находится значительное количество восстановителя, кривая изменяется плавно, даже при добавлении значительных количеств реактива величина Е изменяется медленно. Вблизи точки эквивалентности наблюдается резкое изменение потенциала даже при прибавлении малых количеств реактива. По резкому скачку кривой титрования устанавливают точку эквивалентности, которая не всегда лежит на середине скачка. Характер кривых в методах окисления—восстановления не зависит от разбавления раствора, если стехио-метрические коэффициенты у окислителя и восстановителя одинаковы.
Например, в системе Fe3+ ⇆ Fe2+ и Се4+ ⇄ Се3+ при разбавлении раствора соотношения концентраций остаются те же. Если же стехиометрические коэффициенты различны, то разбавление раствора сказывается на отношениях окисленной и восстановленной форм, и потенциал раствора несколько изменится.
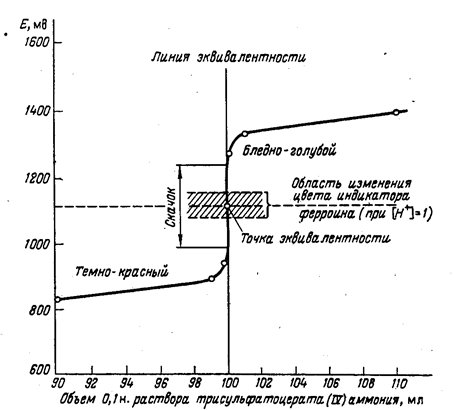
Рис. 4.1. Кривая титрования 0,1 н. раствора соли железа (II) 0,1 н. раствором сульфата церия (IV).
 2014-02-03
2014-02-03 8745
8745
