Методы получения и исследования дисперсных систем
Лекция 8
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент — стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. Хорошо растворимые в воде вещества, но малорастворимые в неполярных органических растворителях не способны образовывать гидрозоли, но могут образовывать органозоли. Так, например, не возможно получить гидрозоль натрия хлорид, но возможно получение его коллоидного раствора в бензоле. И наоборот, можно легко получить гидрозоль камфоры, практически нерастворимой в воде, но невозможно получить ее коллоид в спирте, поскольку камфора хорошо растворима в этом растворителе.
В качестве стабилизаторов используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, белки, полисахариды и др.
По размеру частиц дисперсной фазы коллоидные системы (d ≈10-7— 10-9 м) занимают промежуточное положение между микрогетерогенными (грубодисперсными) системами (d >10-7 м) и истинными растворами, (размер растворенных частиц d < 10-9 м) низкомолекулярных веществ. По способу достижения коллоидной степени дисперсности различают методы (рис. 12.1): диспергационные (от лат.disper-
| Грубодисперсная система | Коллоидно-дисперсная система | Истинный раствор |
| d>l(r7M | 10-7M10-9 | d<10-9M |
| ДИСПЕРГИРОВАНИЕ | КОНДЕНСИРОВАНИЕ |

Увеличение степени измельчения
 Увеличение размеров частиц
Увеличение размеров частиц
Рис.12.1 Способы достижения коллоидной степени дисперсности gire — измельчать) — получение частиц дисперсной фазы путем дробления более крупных частиц и конденсационные (от лат. condensire — укрупнять) — получение частиц дисперсной фазы путем объединения атомов, молекул, ионов
Методы диспергирования. Для измельчения жидкостей и твердых тел необходимо совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы. Энергия, расходуемая при диспергировании, идет на преодоление молекулярных сил притяжения и на увеличение межфазной поверхности
Для достижения требуемой степени дисперсности применяют механическое дробление, ультразвуковое, электрическое и химическое диспергирование.
Механическое дробление осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора. Схема шаровой мельницы представлена на рис. 12.2, а. Шары измельчают материал дисперсной фазы при вращении за счет раздавливания, раскалывания и истирания.
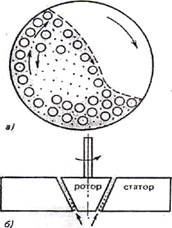 В коллоидных мельницах измельчение материала достигается его истиранием между поверхностями статора и вращающегося ротора (рис. 12.2, б).
В коллоидных мельницах измельчение материала достигается его истиранием между поверхностями статора и вращающегося ротора (рис. 12.2, б).
Измельчение с помощью ультразвука происходит под действием источника ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или твердого тела с жидкостью.
Электрическое диспергирование используют для получения золей металлов. К электродам, изготовленным из диспергируемого металла и опущенным в подщелоченную воду, подводят постоянный электрический ток и сближают электроды до образования электрической дуги. Металл, из которого изготовлены электроды, при этом превращается в пар, конденсирующийся в жидкой среде в золь. При получении органозолей (дисперсионная среда органический растворитель) применяют высокочастотный искровой заряд.
Химическое диспергирование, или пептизация, заключается в химическом воздействии на осадок.
Конденсационные методы. Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнута физическими и химическими методами.
Физическая конденсация имеет в своей основе физические методы воздействия. Чаще всего для получения золей используют метод замены растворителя. Вначале готовят истинный раствор вещества в летучем растворителе (например, канифоли в спирте) и добавляют к жидкости, в которой вещество нерастворимо (например, к воде). Летучий растворитель удаляют нагреванием. В результате происходит резкое понижение растворимости. Молекулы вещества конденсируются в частицы коллоидных размеров и образуется коллоидный раствор.
При химической конденсации для получения коллоидных растворов используют любые реакции, в результате которых образуются труднорастворимые соединения:
гидролиз FeCl3 + 3H2O=Fe(OH)3(T)+3HCl
обмен AgNO3 + KI = Agl (T) + KNO3
восстановление 2HAuCl4 + 3H2O2= 2Au Т +8HC1 + 3O2
окисление 2H2S(P)+O2=2S(T)+ 2H2O
Нейтрализация Ba(OH)2 + H2SO4 = BaSO4((T) + 2H2O
 2014-02-09
2014-02-09 19498
19498