Лекция № 3.
1. Кремнекислородные мотивы в структурах силикатов.
2. Работы Н.В.Белова.
Ксонотлитовая лента - основа структуры многих гидросиликатов кальция. Ксонотлитовая лента - удвоение волластонитовой цепочки.
Силикаты представляют собой особый класс неорганических соединений, основной структурной единицей которых являются изолированные или связанные друг с другом кремнекислородные тетраэдрические группы [SiO4] 4- (ортосиликатные ионы)
0,162нм 0,264нм
 | |||
 | |||
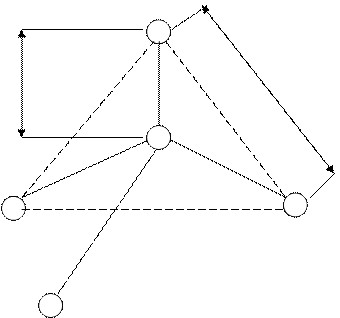
Рисунок 1. - Средние параметры тетраэдрической группы [SiO4] 4- в кремнеземе.
Размеры тетраэдрической группы в силикатах в зависимости от кратности связи и степени ее ионности колеблются в сравнительно узких пределах, в частности, длины связи Si – О составляет в среднем 0,162нм, а расстояние между атомами кислорода 0,264 нм.
Одной из характерных свойств тетраэдрической группы [SiO4] 4- является их способность объединяться друг с другом через общие атомы кислорода, называемыми мостиковыми с образованием связи Si – О – Si. такое объединение может происходить только путем обобщений вершин тетраэдра (а не ребер или граней), причем каждая тетраэдрическая группа может иметь с соседними одну, две, три или все четыре вершины (то есть общих атомов кислорода).
Благодаря этому создаются весь мА разнообразные по характеру сочетания взаимно связанных тетраэдрических групп [SiO4] 4-, образующих различные по составу и строению крупные комплексы, которые в структуре силикатов называют кремнекислородными мотивами или радикалами. Современная классификация основывается именно на характере этих кремнекислородных мотивов.
Кроме кремнекислородных групп в состав силикатов, которые отличаются довольно сложным химическим составом, входят многие другие ионы, в частности: Li, Ne,K, Be, Mg, Ca, Ti, Mn, Fe, Zn, B, Ba, O, H, F, и тд.
Некоторые катионы, прежде всего Al, B, Be обладают способностью имитировать кремний в кремнекислородном радикале, то есть частично изоморфно замещать ион, входя в состав кремнекислородного мотива.
Особую роль в силикатах играет алюминий, который в структуре может заменять двойственное положение.
Первый период изучения структур силикатов был связан с именем В.Л. Брэгга.
В начале 50-х годов Н.В. Белов и его школой были открыты новые цепочки, ленты и другие мотивы в основе которых лежат не одиночные тетраэдры [SiO4] 4-, а диортогруппы [Si 2O7] 6-.
В.Л. Брэггом изучались главным образом силикаты таких катионов как Mg2+, Al2 3+ а так же замещающие их Fe2+, Fe3+. Эти катионы в силикатных структурах имеют координационное число 6.
Н.В. Беловым изучались силикаты с крупными катионами: Na 2+, Ca2+ и др. Основной кремнекислородной единицей является диортогруппа [Si 2O7] 6
Примером цепочек с диортогруппами являются волластонитовая и родонитовая цепочки. В волластоните основой структуры являются бесконечные колонки из поставленных на ребро октаэдров. Каждый второй октаэдр сцеплен сразу с обоими тетраэдрами диортогруппы [Si2O7]6-. Однако поскольку высота диортогруппы несколько больше ребра Са- октаэдра, то группа [Si2O7] 6- искажается, оттягивается, приближаясь по размеру к Са-октаэдру.
Противоположное ребро группы удлиняется и создается возможность связать между собой две диортогруппы всего лишь одним октаэдром
[SiO4] 4- рис. 1 в родоните, в состав которого входят Ca, Mn – октаэдры, цепочки еще больше усложняется и элемент повторяемости этой цепочки содержит две диорто и одну ортогруппу рис.1
Удвоение волластонитовой цепочки дает ксонотлитовую ленту, которая отличается от амфиболовой тем, что состоит не из шестерных, а из восьмерных. Радикал ксонотлитовой ленты [Si 6O17] 10- . Ксонотлитовая лента является основой структуры многих гидросиликатов кальция и входит в структуру либо в виде самостоятельных радикалов либо в виде конденсированных слоев. Эти гидросиликаты играют важную роль в процессах гидратации и твердения цемента. При высоких температурах происходит разрыв лент или слоев, и большинство гидросиликатов превращается в волластонит.
В слоистых силикатах кроме широко распространенной сетки из шестиугольных колец, получающейся конденсацией амфиболовых лент и характерной для талька, слюд, каолинита, существуют и сетки, образованные конденсацией ксонотлитовых и более сложных лент. В их строении как и в строении ксонотлитовых лент, четко выделяется диортогруппа [Si 6O17] 10- .
Диортогруппы можно выделить так же и в каркасных силикатах, в которых присутствуют только крупные катионы, и в некоторых кольцевых силикатах. На основании исследования большинства силикатов с различными катионами Н.В. Белов пришел к выводу, что основная роль в силикатных структурах принадлежат катионным мотивам, к которым лишь приспосабливаются кремнекислородные радикалы. Между ионами кислорода окружающими катион в структуре силиката, располагаются мягкие ионы кремния. Каждый атом кремния занимает в данный момент только одну из шести соседних тетраэдрических пустот, так как согласно правилу Полинга, тетраэдры [SiO4] 4-, не должны иметь общих ребер. Атом кремния может легко мигрировать из одного тетраэдра в другой, чем и объясняется возможность приспосабливания кремнекислородных радикалов к основному мотиву кристаллической структуры. Если основные катионы имеют средние размеры, то соответствующий радикал строится из классических тетраэдров [SiO4]4-, если катионы более крупные кремнекислородные радикалы состоят из диортогрупп [Si 2O7] 6-.
Вопросы:
1. Что такое кремнекислородные мотивы в структурах силикатов?
2. Что является основной кремнекислородной единицей?
3. Размеры тетраэдрической группы в силикатах, длина связи Si – О и расстояние между атомами кислорода.
4. Что такое мостиковая связь?
5. Что Вы знаете о работах Н.В.Белова?
 2014-02-17
2014-02-17 1191
1191








