Рис. 5–5. Изменения метаболизма белков в очаге воспаления.
Белки
Рис. 5–4. Изменения метаболизма липидов в очаге воспаления.
Липиды
Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза.
Причины
• Прямое повреждающее влияние флогогенного агента может привести к ферментативной и неферментативной деструкции мембранных фосфолипидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием кетокислот.
• Основной механизм липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также из лейкоцитов, в большом количестве накапливающихся в очаге воспаления.
Помимо увеличения содержания липаз и фосфолипаз, в очаге воспаления отмечается значительное повышение их активности. Последнее связано с тем, что оптимум каталитической активности большинства липаз и фосфолипаз наблюдается в кислой среде. А в очаге воспаления, как известно, быстро развивается метаболический ацидоз.
• Активация деструкции липидов за счёт интенсификации реакций свободнорадикального перекисного окисления липидов. В очаге воспаления усиление липопероксидных процессов связано со снижением активности антиоксидантных ферментов, увеличением содержания прооксидантных агентов (катехоламинов, гистамина, серотонина; ионов железа, высвобождающихся при разрушении миоглобина, Hb, кининов и других), а также повышением уровня субстратов перекисного окисления липидов, главным образом полиненасыщенных ВЖК: арахидоновой, линоленовой и других. Активация липопероксидации сопровождается образованием и накоплением избытка неметаболизируемых соединений (в частности гидроперекисей липидов), обладающих выраженным разрушающим эффектом в отношении органических соединений.
Проявления
• Активация процессов липолиза и накопление продуктов липолиза
• Торможение реакций синтеза липидов
• Активация перекисного окисления липидов и накопление перекисей и гидроперекисей липидов
Последствия
Последствия изменённого метаболизма липидов в очаге воспаления перечислены на рис. 5–4) и подробнее рассмотрены ниже.
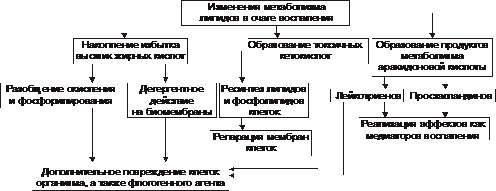
• Активация лизосомальных, а также мембраносвязанных липаз и фосфолипаз приводит к отщеплению от липидов ВЖК и их накоплению. Последние оказывают в очаге воспаления существенный разобщающий эффект и снижают эффективность тканевого дыхания в митохондриях.
• Детергентное (разрушающее) действие ВЖК на клеточные мембраны сопровождается образованием сквозных каналов в мембранах и нерегулируемым транспортом по ним ионов, молекул органических и неорганических соединений, как в клетку, так и из неё, что завершается, как правило, гибелью клетки.
• Накопление избытка токсичных кетокислот (ацетоуксусной, b‑оксимасляной, b‑кетоглутаровой и других) является результатом нарушения окисления ВЖК в очаге воспаления. Эти кетокислоты обусловливают дополнительную альтерацию в очаге воспаления.
• Повреждение вышеуказанными факторами не только клеток организма, но и самого флогогенного агента, если в его состав входят липиды.
• Использование ВЖК для синтеза фосфолипидов мембран и ресинтеза цитоплазматических липидов. ВЖК при этом остаётся одним из основных энергоёмких субстратов биологического окисления.
• В ходе метаболизма арахидоновой кислоты образуются Пг и лейкотриены, обладающие многими регуляторными эффектами.
Обмен белков характеризуется преобладанием протеолиза над процессами протеосинтеза.
Главные причины
• Прямое патогенное действие флогогенного агента, в том числе ферментативный протеолиз.
• Массированное выделение из повреждённых паренхиматозных и стромальных клеток, а также из лейкоцитов протеолитических ферментов. Их активность значительна, так как каталитический оптимум большинства протеаз находится в кислом диапазоне рН (в очаге воспаления — метаболический ацидоз).
• Активация свободнорадикальных и перекисных реакций, сопровождающихся деструкцией ЛП и высвобождением из них белковых соединений, которые разрушаются и/или денатурируются.
Проявления
• Активация процессов протеолиза и накопление продуктов протеолиза.
• Торможение реакций протеосинтеза.
• Денатурация молекул белка (образование аутоантигенов).
Последствия
В очаге воспаления вследствие интенсификации реакций протеолиза и денатурации белков развиваются следующие процессы (рис. 5–5).

• Деструкция мембран клеток, повреждённых флогогенным фактором.
• Разрушение белковых структур и клеток флогогенного агента, когда им являются микроорганизмы, одно‑ и многоклеточные паразиты, а также — белоксодержащие факторы (вирусы, АТ, комплексы Аг‑АТ, токсины и другие соединения).
• Активация иммунных (в том числе — иммунопатологических) реакций в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента. Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур.
• Продукты протеолиза служат субстратом синтеза новых клеточных компонентов взамен повреждённых.
Для ионов и воды характерен трансмембранный дисбаланс ионов, увеличение внутриклеточного содержания Na+ и Ca2+ и внеклеточного содержания K+ и Mg2+, гипергидратация клеток и отёк ткани в очаге воспаления.
Главные причины
• Прямое повреждающее действие флогогенного агента на мембраны клеток.
• Нарушения энергетического обеспечения селективного переноса катионов.
• Расстройства работы ионообменных механизмов (Н+‑Ca2+, Na+‑Ca2+, H+‑K+).
• Снижение кинетической активности катион‑зависимых мембранных АТФаз (Na+,K+‑АТФазы, Ca2+,Mg2+‑АТФазы).
• Нарушения физико‑химического состояния и микроструктуры клеточных мембран. Последнее проявляется:
† фазным увеличением или снижением степени «жёсткости», а следовательно, и проницаемости мембран для ионов;
† дефектами цитоскелета (микрофиламенты, микротрубочки, промежуточные нити, связанные со структурными элементами клеточных мембран).
† Образованием микроразрывов (микробрешей, простейших транспортных каналов) в плазмолемме и мембранах клеточных органелл.
В совокупности эти изменения сопровождаются потерей клеткой K+, Mg2+, ряда микроэлементов и увеличением их концентрации на внешней поверхности клеточной мембраны. Одновременно с этим повышается внутриклеточное содержание Na+ и Ca2+, а также воды.
Проявления
• Нарушения распределения ионов по обе стороны плазмолеммы. При этом происходит потеря клеткой K+, Mg2+, микроэлементов и накопление их в межклеточной жидкости. В клетку же поступают Na+, Ca2+ и некоторые другие ионы.
• Нарушения соотношения между отдельными ионами как в клетке, так и вне клетки в результате расстройства механизмов трансмембранного переноса ионов.
• Гипергидратация ткани в очаге воспаления в связи с высокой гидрофильностью накапливающихся в нём Na+ и Ca2+, а также продуктов гидролиза органических соединений.
• Высвобождение дополнительного количества катионов (K+, Na+, Ca2+, железа, цинка) при гидролизе солей, распаде гликогена, белков и других органических соединений, а также — клеточных мембран.
• Выход большого количества Ca2+ из повреждённых внутриклеточных депо (например, митохондрий и цистерн эндоплазматической сети и митохондрий).
Последствия
• Значительное увеличение осмотического давления внутри клеток, набухание клеток и их органелл, перерастяжение и разрыв мембран и в конце концов — гибель клеток.
• Расстройства формирования МП и ПД, стойкая деполяризация мембран возбудимых клеток (в особенности кардиомиоцитов), сочетающаяся со снижением их функций и болевой чувствительности в центре очага воспаления (в зоне первичной альтерации). По периферии воспалённой ткани (в зоне вторичной альтерации), как правило, регистрируются более или менее сниженный уровень деполяризации мембран, повышенная возбудимость клеток и высокая болевая чувствительность.
Названные выше механизмы дисбаланса ионов и воды действуют не только на клетки организма, но и на флогогенный фактор, что может привести к его повреждению.
Расстройства обмена веществ сопровождаются существенными и закономерными физико‑химическими сдвигами в очаге воспаления.
Физико‑химические изменения
Основные физико‑химические изменения в очаге воспаления приведены на рис. 5–6.

Рис. 5–6. Физико‑химические изменения в очаге воспаления.
 2014-02-09
2014-02-09 626
626








