Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости. Частицы внешней сферы удерживаются комплексным ионом в основном электростатическими силами и легко отщепляются в водных растворах. Эта диссоциация называется первичной и протекает по типу диссоциации сильных электролитов.
Лиганды внутренней сферы связаны центральным атомом намного прочнее (ковалентными связями) и при растворении отщепляются незначительно. Обратимый распад внутренней сферы носит название вторичной диссоциации. Диссоциацию комплекса [Ag(NH3)2]Cl можно записать следующим образом:
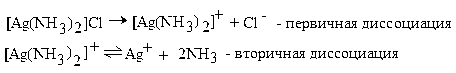
Диссоциация комплексного иона характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами. Как и в случае слабых электролитов, она подчинена закону действия масс и может быть описана соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
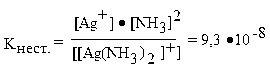
Константы нестойкости комплексных ионов весьма различны (табл. 1.2) и характеризуют термодинамическую устойчивость комплексного иона, которая зависит от прочности связи центрального атома с лигандами. Мерой этой прочности является энергия разрыва донорно-акцепторной связи. Чем ниже значение константы нестойкости, тем прочнее и устойчивее комплекс.
 2014-02-09
2014-02-09 877
877








