Таблица 1.2
Константы нестойкости некоторых комплексных ионов при 25ºС
| Реакция | Кнест. |
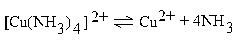 | 8,5 ∙ 10–13 |
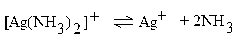 | 9,3 ∙ 10–8 |
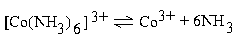 | 2 ∙ 10–34 |
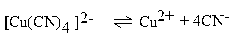 | 5 ∙ 10–31 |
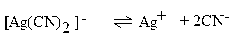 | 1 ∙ 10–20 |
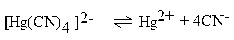 | 3 ∙ 10–42 |
В последнее время вместо константы нестойкости часто используют обратную ей величину, называемую константой устойчивости. Для иона [Ag(NH3)2]+ константа устойчивости равна:
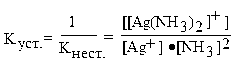 .
.
Диссоциация комплексного иона не всегда заканчивается только конечными продуктами. В действительности в растворах имеет место ступенчатый процесс, аналогичный процессу у слабых электролитов (например, у многоосновных кислот), где каждая ступень диссоциации характеризуется своей константой нестойкости:
1 ступень
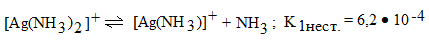 ,
,
2 ступень
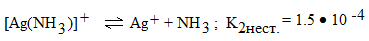 .
.
Причем всегда К1нест. > К2нест. > К3нест. > …
Общая константа нестойкости равна произведению констант всех ступеней диссоциации комплексного иона:
Кнест. [Ag(NH3)2] + = К1 ∙ К2 = 6,2 ∙ 10–4 ∙ 1,5 ∙ 10–4 = 9,3 ∙ 10– 8.
С помощью Кнест. или Куст. можно предсказать течение реакций образования и распада комплексных ионов. При сильном различии констант нестойкости реакция пойдет в сторону формирования иона с меньшей константой нестойкости или, что равноценно, с большей константой устойчивости. То же относится и к реакциям распада. Например, если на ион [Ag(NH3)2]+ с Кнест. = 9,3 ∙ 10–8 подействовать сильной кислотой, то аммиакат серебра разрушается с образованием ионов Ag+ и NH4+, с константой для NH4+ = 6 ∙ 10–10:
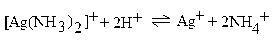 .
.
В то же время комплексный ион [Pt(NH3)4]2+, с константой нестойкости намного более низкой (5 ∙ 10–34), чем у комплексного иона серебра, сохраняет стабильность при комнатной температуре даже в концентрированной соляной кислоте.
По значениям констант диссоциации, с использованием изотермы реакции, нетрудно рассчитать стандартную энергию Гиббса: ΔGº = RTlnКнест., которая является энергетической характеристикой процесса комплексообразования.
У ряда комплексных соединений константа нестойкости чрезвычайно велика и в водных растворах они практически полностью распадаются на составляющие их ионы. В первую очередь это относится к соединениям, для которых более принятым считается название двойные соли: K2[CuCl4] ≡ CuCl2 ∙ 2KCl. В воде равновесие 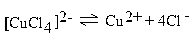 настолько смещено вправо, что комплексных ионов [CuCl4]2– почти не остается. Содержание их возрастает по мере концентрирования растоворов. Это означает, что чёткой границы между комплексными и двойными солями, а также кристаллогидратами, которые можно отнести к двойным солям (KCl ∙ MgCl2 ∙ 6H2O; (NH4)2SO4 ∙ FeSO4 ∙ 6H2O и др.), не существует. Двойная соль отличается от комплексной лишь степенью диссоциации: у комплексной она незначительная, у двойной – практически полная.
настолько смещено вправо, что комплексных ионов [CuCl4]2– почти не остается. Содержание их возрастает по мере концентрирования растоворов. Это означает, что чёткой границы между комплексными и двойными солями, а также кристаллогидратами, которые можно отнести к двойным солям (KCl ∙ MgCl2 ∙ 6H2O; (NH4)2SO4 ∙ FeSO4 ∙ 6H2O и др.), не существует. Двойная соль отличается от комплексной лишь степенью диссоциации: у комплексной она незначительная, у двойной – практически полная.
Комплексные соединения образуются в тех же химических реакциях, что и простые соединения первого порядка: в реакциях соединения, обмена, замещения. Поскольку степени окисления атомов, входящих в состав реагирующих веществ, в реакциях замещения меняются, их принято называть реакциями окисления-восстановления.
Реакции соединения:
HgI2 + 2KI = K2[HgI4];
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
CuSO4 + 4NH3 = [Cu(NH3)4]SO4;
Fe + 5CO = [Fe(CO)5].
– обмена:
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4;
ZnCl2 + (NH4)2[Hg(SCN)4] = Zn[Hg(SCN)4] + 2NH4Cl;
CoCl2 + 2Na2C2O4 = Na2[Co(C2O4)2] + 2NaCl.
– окисления-восстановления:
Zn + 2[Ag(NH3)2]Cl = [Zn(NH3)4]Cl2 + 2Ag;
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl.
Вероятность комплексообразования простых молекул в более сложные определяется возможностью формирования термодинамически более устойчивых соединений:
произведение растворимости HgI2, Zn(OH)2 в первых реакциях больше Кнест. [HgI4]2-, [Zn(OH)4]2- соответственно; а Кнест. [Ag(NH3)2]+, [Fe(CN)6]4- в последних больше Кнест. [Zn(NH3)4]2+, [Fe(CN)6]3-.
 2014-02-09
2014-02-09 3912
3912
