Природа химической связи в комплексном ионе
Механизм образования комплексных соединений и, прежде всего, природа химической связи комплексообразователя и лигандов в современной химии описываются исходя из электростатических и квантовомеханических представлений, ставших основой трех более или менее отличных друг от друга теорий. Хронологически и по увеличению сложности первой считается электростатическая теория с её более совершенной модификацией – теорией кристаллического поля, второй – метод валентных связей и третьей – метод молекулярных орбиталей. Сочетание последней теории с теорией кристаллического поля привело к интенсивному развитию нового подхода, известного под названием теории поля лигандов.
Согласно этой теории, образование многих комплексных соединений в первом приближении можно объяснить электростатическим притяжением между центральным катионом металла и противоположно заряженными анионами или полярными молекулами лигандов. При достаточном их сближении в пространстве в формирующемся комплексном ионе наряду с силами притяжения начинают действовать силы электростатического отталкивания, особенно между одноименно заряженными или, в случае полярных молекул, одинаково ориентированными лигандами. В результате возникает правильное геометрическое расположение лигандов и образуется устойчивая структура, с минимальной потенциальной энергией. Количественные расчеты В. Косселя и А. Магнуса (1916-1922 г.г.) подтверждают правомочность такой модели, показывают прямую зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить своеобразие реакционной способности комплексных соединений, их магнитные свойства, окраску, избирательность (специфичность) комплексообразования, поскольку не принимает во внимание природу центрального иона и лигандов, особенности строения их электронных оболочек, взаимное влияние ионов друг на друга. Более полно и точно образование химических связей, свойства и организацию комплексных соединений объясняют теории, основанные на квантовомеханических представлениях о строении атомов и молекул: метод валентных связей и метод молекулярных орбиталей.
1.2.2. Метод валентных связей
Метод валентных связей к комплексным соединениям впервые применил американский химик Л. Полинг в 30-х годах прошлого столетия. Полинг исходил их следующих допущений:
- для образования ковалентных связей с орбиталями лиганда центральный атом или ион металла должен содержать некоторое число пустых (вакантных) орбиталей, определяющих его координационную валентность;
- ковалентные связи образуются перекрыванием вакантных орбиталей атома (иона) металла с заполненными орбиталями донорного иона (лиганда). Донорный ион обязан иметь для этого, по крайней мере, одну неподеленную пару электронов:





 |
молекула молекула молекула ион ион ион
воды аммиака монооксида гидроксила циана фтора углерода
Формирующиеся в комплексах σ-связи являются двухэлектронными и двухцентровыми, а образование их протекает по донорно-акцепторному механизму;
- чем больше электронные облака перекрывают друг друга, тем более прочной является возникающая химическая связь. Для удовлетворения этого критерия необходимо, чтобы исходные атомные орбитали были гибридизованы и формировали новую систему перекрывающихся эквивалентных орбиталей с определенной направленностью в пространстве.
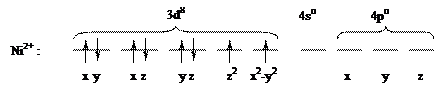 |
Рассмотрим с позиции метода валентных связей образование химических связей между комплексообразователем и лигандами на конкретных примерах. В комплексной соли K2[NiCl4] конфигурация валентной оболочки иона никеля Ni2+ в основном состоянии описывается формулой 3d84s04p0 и может быть представлена в виде диаграммы заполнения ячеек:
Согласно диаграммы, Ni2+ имеет четыре вакантные орбитали: 4s, 4px, 4py, 4pz. Ионы хлора на внешней оболочке содержат свободные неподеленные пары электронов - 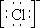 . Под действием электрического поля ионов хлора ион никеля (II) из основного переходит в возбужденное состояние с гибридизацией одной 4s и трех 4p-орбиталей:
. Под действием электрического поля ионов хлора ион никеля (II) из основного переходит в возбужденное состояние с гибридизацией одной 4s и трех 4p-орбиталей:
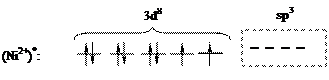 |
Последующее перекрывание вакантных sp3-атомных орбиталей возбужденного иона Ni2+ c двухэлектронными sp3-атомными орбиталями ионов хлора приводит к обобщению четырех неподеленных электронных пар хлора и формированию комплексного иона [NiCl4]2–, с тетраэдрической ориентацией лигандов (тетраэдрическая координация):
 |
Возникают четыре равноценные двухэлектронные σ-связи Ni2+ – Cl–, аналогичные по свойствам одинарным σ-связям в простых бинарных соединениях (рис. 1.2):

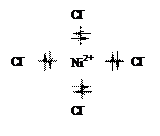
 2014-02-09
2014-02-09 1700
1700
