ш, = = 10,4 г — глюкозы необходимо на 200 мл изотони-
0' i ■ i00
ческого раствора.
При двух компонентах в прописи для расчета изотонических концентраций используют формулу:
(0,52 - At2 ■ C2) ■ V
m i =-------------- -2--- И----,
At1 ■100
где m2 — количество вещества, необходимое для изотонирования раствора, г; 0,52 °С — депрессия температуры замерзания сыворотки крови;
At2 — депрессия температуры замерзания 1 %-ного раствора прописанного вещества;
С2 — концентрация прописанного вещества, %;
At1 — депрессия температуры замерзания 1 %-ного раствора вещества, взятого для изотонирования раствора, прописанного в рецепте;
V — объем прописанного в рецепте раствора, мл;
Например:
At
At,
Rp.: Sol. Novocaini 2 % 100 ml
Natrii sulfatis q.s.,
ut fiat sol. isotonica Sterilisa!
Da. Signa. Для инъекций
депрессия температуры замерзания 1 %-ного раствора натрия сульфата (0,15 °С);
депрессия температуры замерзания 1 %-ного раствора новокаина (0,122 °С);
концентрация раствора новокаина (2 %).
m i
(0,52 - 0,122 ■ 2) ■ 100 0,15 ■ 100
1,84 г натрия сульфата.
Следовательно, для приготовления изотонического раствора новокаина по приведенному рецепту необходимо взять 2,0 г новокаина и 1,84 г натрия сульфата.
При трех и более компонентах в прописи для расчета изотонических концентраций пользуются формулой:
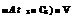 m з
m з
0,52 - (At2 ■ C2
At 100
где m3 0,52 °С
At
С2
Сз V
количество вещества, необходимое для изотонирования раствора, г; депрессия температуры замерзания сыворотки крови; депрессия температуры замерзания 1 %-ного раствора вещества, взятого для изотонирования раствора, прописанного в рецепте; депрессия температуры замерзания 1 %-ного раствора второго компонента в рецепте;
концентрация второго компонента в рецепте, %;
депрессия температуры замерзания раствора третьего компонента в рецепте;
концентрация третьего компонента в рецепте; объем раствора, прописанного в рецепте.
Например:
Rp.: Atropini sulfatis 0,2
Morphini hydrochloridi 0,4
Natrii chloridi q.s.
Aquae pro injectionibus ad 20 ml ut fiat solutio isotonica Sterilisa!
Da. Signa. Для инъекций
At1 — депрессия температуры замерзания 1 %-ного раствора натрия хлорида (0,576 °С);
At2 — депрессия температуры замерзания 1 %-ного раствора атропина сульфата (0,073 °С); С2 — концентрация атропина сульфата (1 %);
At3 — депрессия температуры замерзания 1 %-ного раствора морфина гидрохлорида (0,086 °С); С3 — концентрация морфина гидрохлорида (2 %); V — объем раствора, прописанного в рецепте.
0,52 - (0,073 ■ 1 + 0,086 ■ 2) ■ 20
m3 =------------------------------------------------ = 0, 0955 «0,1 г натрия хлорида.
Atj ■ 100
При расчете изотонической концентрации по криоскопическому методу основной источник ошибок — отсутствие строгой пропорциональной зависимости между концентрацией и депрессией. Важно отметить, что отклонения от пропорциональной зависимости индивидуальны для каждого лекарственного вещества.
Так, для раствора калия йодида имеется практически линейная (пропорциональная) зависимость между концентрацией и депрессией. Поэтому изотоническая концентрация некоторых лекарственных веществ, определенная экспериментальным методом, близка к расчетной, для других же наблюдается значительная разница.
Второй источник ошибок — погрешность опыта при практическом определении депрессии 1 %-ных растворов, о чем говорят различные значения депрессий (At), опубликованные в некоторых источниках.
Расчет изотонических концентраций с использованием эквивалентов по натрия хлориду. Более универсальный и точный метод расчета изотонических концентраций растворов фармакопейный (принят ГФ XI) основан на использовании изотонических эквивалентов лекарственных веществ по натрия хлориду. В аптечной практике он используется наиболее часто.
> Изотонический эквивалент (Е) по натрия хлориду показывает количество натрия хлорида, создающее в одинаковых условиях осмотическое давление, равное осмотическому давлению 1,0 г лекарственного вещества.
Например, 1,0 г новокаина по своему осмотическому эффекту эквивалентен 0,18 г натрия хлорида (см. приложение 4 учебника). Это означает, что 0,18 г натрия хлорида и 1,0 г новокаина создают одинаковое осмотическое давление и в равных условиях изотонируют одинаковые объемы водного раствора.
Зная эквиваленты по натрия хлориду, можно изотонировать любые растворы, а также определить изотоническую концентрацию. Например:
1,0 г новокаина эквивалентен 0,18 г натрия хлорида, а 0,9 г натрия хлорида — х г новокаина;
0,9 ■ 1
x =---------- = 5, 0 г.
0,18
Следовательно, изотоническая концентрация новокаина составляет 5 %.
Rp.: Dimedroli 1,0
Natrii chloridi q.s.
Aquae pro injectionibus ad 100 ml ut fiat solutio isotonica Sterilisa!
Da. Signa. Внутримышечно по 2 мл 2 раза в день
Для приготовления 100 мл изотонического раствора натрия хлорида потребовалось бы 0,9 г (изотоническая концентрация — 0,9 %).
Однако, часть раствора изотонируется лекарственным веществом (димедролом).
Поэтому сначала учитывают, какая часть прописанного объема изотонируется 1,0 г димедрола. При расчете исходят из определения изотонического эквивалента по натрия хлориду. По таблице (приложение 4) находят, что Е димедрола по натрия хлориду равен 0,2 г, то есть 1,0 г димедрола и 0,2 г натрия хлорида изотонируют одинаковые объемы водных растворов.
Далее определяют, какое количество натрия хлорида необходимо добавить для изотонирования: 0,9 — 0,2 = 0,7 г.
Rp.: Solutionis Novocaini 2 % 200 ml
Natrii chloridi q.s.,
ut fiat solutio isotonica Sterilisa!
Da. Signa. Для внутримышечного введения
В данном случае для приготовления 200 мл изотонического раствора натрия хлорида потребовалось бы 1,8 г:
0,9 — 100 _ 200 ■ 0,9 _ 1 _
х — 200 x = I- = 1,8 г.
Прописанные 4,0 г новокаина эквивалентны 0,72 г натрия хлорида:
1,0 новокаина 0,18 натрия хлорида _ 4,0 °, 1 8 ___ «72 г
40 х x =,= 0 г.
новокаина натрия хлорида 1
Следовательно, натрия хлорида надо взять 1,8 — 0,72 = 1,08 г.
Rp.: Strichnini nitratis 0,1 % 50 ml
Natrii nitratis q.s., ut fiat solutio isotonica Sterilisa!
Da.Signa. По 1 мл 2 раза в день под кожу
Вначале определяют количество натрия хлорида, необходимое для приготовления 50 мл изотонического раствора:
0,9 — 100 50 0, 9
х 50 x =------------ = 0,45 г.
Далее устанавливают, какому количеству натрия хлорида соответствуют 0,05 г (прописано по рецепту) стрихнина нитрата:
1,0 г стрихнина нитрата 0,12 г натрия хлорида x __________ 0,12 0,05 ____ 0 ~ 0 01 Г
0,05 гстрихнина нитрата х г натрия хлорида 1
Следовательно, натрия хлорида требуется 0,45 — 0,01 = 0,44 г.
Но в рецепте указано, что раствор необходимо изотонировать на-
трия нитратом. Поэтому проводят перерасчет на это вещество (экви-
валент натрия нитрата по натрия хлориду — 0,66):
0,66 г — 1,0 г 0, 44 1
' ± натрия хлорида___________ > J А натрия нитрата д- — — ~ 0 67 Г
0,44 г натрия хлорида х г натрия нитрата 0, 66
Таким образом, по приведенному рецепту для изотонирования требуется 0,67 г натрия нитрата.
Исходя из известных эквивалентов по натрия хлориду, были вычислены изотонические эквиваленты по глюкозе, натрия нитрату, натрия сульфату и кислоте борной, которые приведены в приложении 4 учебника. С их использованием приведенные выше расчеты упрощаются. Например:
Rp.: Solutionis Ephedrini hydrochloridi 2 % 100 ml
Glucosi q.s.,
ut fiat solutio isotonica
Da. Signa. Для инъекций
Изотонический эквивалент эфедрина гидрохлорида по глюкозе равен 1,556. Прописанные в рецепте 2,0 г эфедрина гидрохлорида будут создавать такое же осмотическое давление, как 3,11 г глюкозы (2,0*1,556). Так как изотоническая концентрация глюкозы равна 5,22 %, для изотонирования раствора эфедрина гидрохлорида ее следует взять 5,22 - 3,11 = 2,11 г.
Расчет изотонических концентраций по формулам. Осмотическое давление в водных растворах одного или нескольких веществ (которое равно осмотическому давлению 0,9 %-ного раствора натрия хлорида) можно выразить следующим уравнением:
m1'E1 + m2-E2 +... + mn-En + mx«Ex = 0,009-V, откуда
m x = J_ 0,009 ■ V" ~ (m + m ^ m.), a)
где mx — масса искомого вещества, г;
Ex — изотонический эквивалент по натрия хлориду искомого вещества; m1, m2... — массы прописанных в рецепте веществ; E1, E2... — изотонические эквиваленты веществ по натрия хлориду; V — объем раствора.
По формуле (1) можно определить количество различных лекарственных или вспомогательных веществ, которые необходимо добавить к раствору до изотонии для водных инъекций, глазных капель, примочек, полосканий.
Например:
Rp.: Solutionis Morphini hydrochloridi 1 % 100 ml
Glucosi q.s.,
ut fiat solutio isotonica Sterilisa!
Misce. Da. Signa. По 1 мл под кожу
mглюкозы = 1 (0,009 ■ V -m 1 ■ Е1) = — (0, 009 ■ 100 - 1 ■ 0,15) = 4,17 г.
ЕглюКозы 0,18
Для изотонирования инъекционного раствора необходимо добавить 4,17 г глюкозы безводной сорта «Для инъекций».
Rp.: Solutionis Argenti nitratis 0,5 % 10 ml
Natrii nitratis q.s.,
ut fiat solutio isotonica Misce. Da. Signa. По 2 капли 1 раз в день
mнатрия нитрата = (0,009 • 10 - 0,05 ■ 0,33) = 0,11 г.
0, 66
Rp.: Solutionis Magnesii sulfatis isotonica 100 ml Sterilisa!
Da. Signa. По 10 мл внутривенно 1 раз в день
m-E = 0,009-V
_ 0,009 ■ 100 ульфата _ 0 14
6,43 г.
Для приготовления изотонического раствора необходимо взять 6,43 г магния сульфата сорта «Для инъекций».
Изотонический раствор натрия хлорида (0,9 %-ный) создает осмотическое давление, равное 7,4 атм. Такое же осмотическое давление имеет плазма крови. Определить осмотическое давление в инъекционном растворе можно по следующей формуле:
(m j ■ Е j + m 2 ■ Е 2 +... + m n ■ Е n) ■ 7,4 ■ 100 (2)
0, 9 ■ V
где Р — осмотическое давление, атм. Например:
Rp.: Natrii chloridi 5,0
Kalii chloridi 1,0
Natrii acetatis 2,0
Aquae pro injectionibus ad 1000 ml Sterilisa!
Misce. Da. Signa. Для внутривенного введения («Ацесоль»)
„ (5 ■ 1 + 1 ■ 0,76 + 2 ■ 0,46) ■ 7,4 ■ 100 r „„
P -±----------------- :-------------- :—'-—:------------------ - 5,49 атм.
0, 9 ■ 1000
Раствор «Ацесоль» гипотоничен. Необходимо приготовить раствор, чтобы он был изотоническим, сохраняя соотношение солей — натрия хлорид: калия хлорид: натрия ацетат — 5: 1: 2 (или то же самое 1: 0, 2: 0,4).
Количество веществ, которые должны быть в растворе (сохраняя их соотношение и при этом раствор должен быть изотоничным), можно рассчитать по следующей формуле:
И 0,009 ■ V ■ m (j,2,3) (3)
т-. т- ' (3)
mi ■ Ei + m2 ■ Е2 + m3 ■ Е3
где mH — масса искомого вещества, г;
m1 — масса натрия хлорида в растворе «Ацесоль», г; m2 — масса калия хлорида в растворе «Ацесоль», г; m3 — масса натрия ацетата в растворе «Ацесоль», г; E1, E2, E3 — соответствующие изотонические эквиваленты по натрия хлориду; V — объем раствора.
и = 0,009 ■ 1000 ■ 5 = 6
mнатрИяхлорИда 5 ■ 1 + 0,76 + 2 ■ 0,46 Г'
и 0,009 ■ 1000 ■ 1
m —---------------------- — 1 34 / г*
калия хлорида А' ' 1 '
6, 68
m и — 0 009 ^1000 ^ 2 — 2694 г
натрия ацетата г га ^i^s-vi
6 68
(сумма 5-1 + 1-0,76 + 2-0,46 равна 6,68).
Таким образом, чтобы раствор был изотоничным и при этом сохранялось соотношение солей как 1: 0, 2: 0,4, к нему необходимо добавить: натрия хлорида 6,736 — 5 =1,74 г, калия хлорида 1,347 — 1 = 0,35 г, натрия ацетата 2,694 — 2 = 0,69 г.
Расчет по формуле (3) можно проводить для гипертонических растворов с целью уменьшения количества веществ и приведения растворов к норме (изотонии).
Формулы (1), (2) и (3) впервые предложил для использования в аптечной практике ассистент кафедры технологии лекарств Запорожского медицинского института кандидат фармацевтических наук П. А. Логвин.
Наряду с изотоничностью важной характеристикой осмотического давления растворов является осмолярность. Осмолярность (осмоляльность) — величина оценки суммарного вклада различных растворенных веществ в осмотическое давление раствора.
Единицей осмолярности является осмоль на килограмм (осмоль/кг), на практике обычно используется единица миллиосмоль на килограмм (мосмоль/кг). Отличие осмолярности от осмоляльности в том, что при их расчете используют различные выражения концентрации растворов: молярную и моляльную.
Осмолярность — количество осмолей на 1 л раствора. Осмоляльность — количество осмолей на 1 кг растворителя. Если нет других указаний, осмоляль-ность (осмолярность) определяют с помощью прибора осмометра.
Определение величины осмолярности растворов важно при применении парентерального питания организма. Фактором ограничения при парентеральном питании является вводимое количество жидкости, оказывающее воздействие на систему кровообращения и водно-электролитный баланс. Учитывая определенные пределы «выносливости» вен, нельзя использовать растворы произвольной концентрации. Осмолярность около 1100 мосмоль/л (20 %-ный раствор сахара) у взрослого является верхней границей для введения через периферическую вену.
Осмолярность плазмы крови составляет около 300 мосмоль/л, что соответствует давлению около 780 кПа при 38 С, которая является исходной точкой стабильности инфузионных растворов. Величина осмолярности может колебаться в пределах от 200 до 700 мосмоль/л.
Технология изотонических растворов. Изотонические растворы готовят по всем правилам приготовления растворов для инъекций. Наиболее широкое применение получил изотонический раствор натрия хлорида.
Rp.: Solutionis Natrii chloridi 0,9 % 100 ml Sterilisa!
Da. Signa. Для внутривенного введения
Для приготовления раствора натрия хлорид предварительно нагревают в суховоздушном стерилизаторе при температуре 180 °С в течение 2 часов с целью разрушения возможных пирогенных веществ. В асептических условиях на стерильных весочках отвешивают простерилизованный натрия хлорид, помещают в стерильную мерную колбу вместимостью 100 мл и растворяют в части воды для инъекций, после растворения доводят водой для инъекций до объема 100 мл. Раствор фильтруют в стерильный флакон, контролируют качество, герметически укупоривают стерильной резиновой пробкой под обкатку металлическим колпачком. Стерилизуют в автоклаве при температуре 120 °С в течение 8 минут. После стерилизации проводят вторичный контроль качества раствора и оформляют к отпуску. Срок годности раствора, приготовленного в условиях аптек,— 1 месяц.
ППК
Дата № рецепта
Natrii chloridi 0,9
Aquae pro injectionibus ad 100 ml
Sterilis VK = 100 ml
общ
Приготовил: (подпись)
Проверил: (подпись)
ПЛАЗМОЗАМЕНЯЮЩИЕ (ФИЗИОЛОГИЧЕСКИЕ) РАСТВОРЫ
Характеристика и классификация плазмозаменяющих растворов. При потере крови, нарушении водно-электролитного баланса и кислотно-щелочного состояния организма возникает необходимость введения в кровяное русло значительных объемов кровезамещаю-щих жидкостей. Простейший из них изотонический раствор натрия хлорида, введение которого оказывает благоприятное гемодинами-ческое действие. Однако этот раствор не может поддерживать постоянным ионный состав плазмы, а в некоторых случаях необходимо введение более сложных растворов, в состав которых входит ряд солей, имеющихся в плазме крови.
> Плазмозаменяющие растворы (ранее назывались физиологическими, или кровезаменяющими, жидкостями) — это растворы, которые по составу растворенных веществ способны поддерживать жизнедеятельность клеток и органов и не вызывают существенных сдвигов физиологического равновесия в организме.
На этом основании неправильно называть «физиологическим» изотонический раствор натрия хлорида, введение больших доз которого приводит к изменению соотношения между минеральными солями плазмы, вызывает болезненное состояние в виде «солевой лихорадки», а иногда «солевую гликозурию».
В настоящее время принята классификация, которая делит плаз-мозаменяющие растворы на следующие группы:
1. Регуляторы водно-солевого и кислотно-щелочного равновесия (растворы Рингера, Рингера—Локка, лактасоль, ацесоль, ди-соль, трисоль, хлосоль, квартасоль и др.); солевые растворы, осмодиуретики. Осуществляют коррекцию состава крови при обезвоживании.
2. Гемодинамические (противошоковые) кровезаменители (по-лиглюкин, реополиглюкин, желатиноль, декстран). Предназначены для лечения шока различного происхождения и восстановления нарушений гемодинамики, в том числе микроциркуляции, при использовании аппаратов искусственного кровообращения для разведения крови во время операций и т. д.
3. Дезинтоксикационные кровезаменители (гемодез, полидез). Способствуют выведению токсинов при интоксикациях различной этиологии.
4. Препараты для парентерального питания (гидролизин, ами-нопептид, полиамин). Служат для обеспечения энергетических ресурсов организма, доставки питательных веществ к органам и тканям.
5. Кровезаменители с функцией переноса кислорода. Предназначены для восстановления дыхательной функции крови.
6. Кровезаменители комплексного действия. Обладают широким диапазоном действия, могут включать несколько групп плаз-мозаменяющих растворов.
Требования, предъявляемые к плазмозаменяющим растворам. В зависимости от назначения различают и требования к отдельным группам инфузионных растворов, но общее для них то, что они должны полностью выводиться из организма, не нарушая функций органов, обладать постоянными физико-химическими свойствами, быть нетоксичными, апирогенными, стерильными, стабильными при длительном хранении.
Одно из основных требований к инфузионным растворам, вводимым в значительных количествах при кровопотерях,— это соблюдение физиологического соответствия между составом жидкости организма и инъекционной жидкостью.
Такое соответствие достигается при условии, если вводимая в организм жидкость будет иметь:
— соответствие осмотического давления вводимого раствора осмотическому давлению жидкостей организма (изотония);
— определенную концентрацию, состав и соотношение ионов (изо-иония);
— определенное рН раствора (изогидрия);
— определенную вязкость.
Таким образом, плазмозамещающими растворами называют такие растворы, которые по своему осмотическому давлению, ионному составу и значению рН близки к кровяной плазме. Их называют иногда уравновешенными или эквилибрированными растворами, а также по названию учреждения или фамилии автора, предложившего раствор.
Изотония (см. с. 501—513).
И з о и о н и я. Плазмозаменяющие растворы должны содержать в своем составе ионы жизненно важных веществ в том соотношении, в котором они находятся в плазме крови (Na+, К+, Са2+, Mg2+, РО|-
и др.).
Ионы кальция обеспечивают общее стимулирующее действие, ионы калия оказывают возбуждающее действие на блуждающий нерв и тем самым на сердечную мышцу, угнетая работу сердца. Ионы магния вызывают перистальтику кишечника, что особенно важно при полостных операциях. Плазмозамещающие растворы должны содержать взаимообезвреживающий комплекс ионов натрия, калия, кальция, магния, причем в тех же соотношениях, в каких они находятся в кровяной плазме. В настоящее время разработаны методы приготовления плазмозамещающих растворов, обогащенных микроэлементами, поскольку в крови содержится более 40 элементов, выполняющих важную физиологическую роль.
Научные исследования показали, что для обеспечения более или менее длительной жизнедеятельности клеток в жидкость следует добавлять легкоусвояемые питательные вещества, необходимые для восполнения энергетических затрат органов. С целью обеспечения питания клеток и создания необходимого окислительно-восстановительного потенциала в физиологические растворы вводят глюкозу. В крови содержится глюкоза в количестве 5—6 моль. С ее помощью в печени, сердечной мышце и других органах осуществляется окисление различных вредных продуктов обмена веществ и превращение их в безвредные для организма продукты. Поэтому глюкоза необходима для выравнивания в физиологическом растворе восстановительного потенциала.
Изогидрия. Изогидричными называют такие растворы, в которых рН соответствует рН плазмы крови или других жидкостей организма, в которые вводят этот раствор.
Концентрация водородных ионов в разных жидкостях организма различна, например, кровяная сыворотка имеет слабощелочную реакцию, рН находится в пределах от 7,34 до 7,36, а спинномозговая жидкость — от 7,71 до 7,85. При напряженной мышечной работе рН в тканевой жидкости снижается до 6,6. Как уже указывалось выше, для стабильности изотонических растворов концентрация водородных ионов играет существенное значение как в роли консерванта, так и стабилизатора растворов. ГФУ рекомендует для этого при приготовлении стерильных растворов, особенно в заводском производстве, добавлять различные стабилизаторы (см. «Стабилизация растворов для инъекций» с. 490—498).
В тех случаях, когда физиологический раствор используется в больших количествах, появляется необходимость готовить его изо-гидричным, иначе будет нарушаться концентрация водородных ионов крови. Как известно, в процессе жизнедеятельности клеток и органов образуются кислые продукты обмена, нейтрализуемые за счет буферных систем крови, таких, как карбонатный, фосфатный и др. Вот почему в инфузионные растворы стали вводить аналогичные регуляторы рН среды, в результате растворы становятся уравновешенными (эквилибрированными).
Для поддержания определенного значения рН (равное значению рН плазмы крови) применяют:
1. Карбонатную систему (NaHCO3 + CO2).
2. Фосфатную систему (Na2HPO3 + NaH2PO4).
3. Белковые системы амфолитов (амфолиты — вещества, облада-
ющие в водном растворе одновременно свойствами кислот и основа-
ний).
Для сохранения нейтральной реакции добавляют одно- и двуза-мещенные фосфаты, для кислой — смесь слабой кислоты со своей солью, например, уксусную кислоту и ацетат натрия. Наиболее часто добавляют фосфаты и гидрокарбонаты, которыми в организме регулируется определенное значение рН, например, если в организм попадает кислота, то она вступает в реакцию с гидрокарбонатом натрия (буфер): HCl + NaHCO3 = NaCl + H2O + CO2. Кислая среда исчезает в результате образования соли, которая является составной частью кровяной сыворотки, а СО2 легко выводится из организма.
Если в крови образуется небольшое количество кислоты, то значение рН почти не изменяется при введении растворов, вследствие реакции:
NaHCO3 + HCl = NaCl + CO2 + H2O
или Na2HPO4 + HCl = NaCl + NaH2PO4
Кроме того, углерода диоксид дает возможность при введении в кровяное русло вызывать возбуждение дыхательных сосудодвигатель-ных центров и тем самым улучшать дыхание и кровообращение.
Вязкость. Обычные плазмозамещающие растворы имеют существенный недостаток: их действие кратковременно и приблизительно через 2 часа этот раствор выводится из сосудов. В результате этого количество жидкости в кровяном русле резко уменьшается и артериальное давление падает.
Проблема создания плазмозаменяющих растворов с вязкостью, близкой вязкости крови (1,5—1,6 сантипуаз), очень сложна. На основании экспериментальных исследований стало очевидным, что для обеспечения вязкости инфузионных растворов необходимо добавление специальных веществ. Такими веществами являются высокомолекулярные соединения. Они очень мало изменяют значение осмотического давления (большая молекулярная масса) и, вследствие того, что не переходят в мочу, задерживают выделение воды и растворение в ней соли. Поиски веществ, которые могли бы обеспечить жидкостям необходимую вязкость, продолжались в течение длительного времени. Так, предлагалось для этой цели использовать растворы гуммиарабика, абрикосовой камеди. Однако, эти вещества не усваиваются организмом и, оставаясь в русле крови, склеивают эритроциты. Растворы казеина, желатина, желатозы и некоторых белков, выделенных (без специальной обработки) из крови животных, также не могли быть использованы для указанных целей, так как многие из них являются чужеродными белками и вызывают анафилаксию и другие осложнения.
В настоящее время плазмозамещающие (инфузионные) растворы с вязкостью, близкой вязкости крови, приготовляются с добавлением следующих компонентов: человеческой крови, гетерогенного белка, высокомолекулярных соединений растительного происхождения, синтетических высокополимеров. Новые и реальные возможности в решении вопроса по обеспечению вязкости инфузионных растворов появились с открытием декстрана и синтезом поливинилпирролидона.
Декстран (предложен ЦОЛИПК) — водорастворимый высокопо-лимер глюкозы, который получают из свекловичного сахара путем ферментативного гидролиза, то есть воздействием микроорганизмов (Leuconoston mesenteroydes), превращающих в соответствующих условиях сахарозу в высокомолекулярное соединение «декстран», с молекулярной массой 50000±10000, из которого готовят поли-глюкин, реополиглюкин, рондекс, реоглюман.
Плазмозамещающие растворы, содержащие вещества, повышающие вязкость, используют в качестве противошоковых и дезинток-сикационных.
Растворы-регуляторы водно-солевого и кислотно-щелочного равновесия. В условиях аптек готовят, главным образом, плазмозаме-няющие растворы, относящиеся к первой группе. Это растворы Рин-гера, Рингера—Локка, ацесоль, дисоль, трисоль, квартасоль, хлосоль
и др.
Раствор Рингера—Локка.
Rp.: Natrii chloridi 1,8
Kalii chloridi 0,04
Calcii chloridi 0,04
Natrii hydrocarbonatis 0,04
Glucosi 0,2
Aquae pro injectionibus ad 200 ml
Sterilisa!
Da. Signa. Для внутривенного введения
Солевой физиологический раствор для внутривенного введения. При совместном присутствии натрия гидрокарбоната и кальция хлорида возможно образование осадка кальция карбоната. Поэтому готовят два раствора. При приготовлении используют стерильный 20 %-ный раствор кальция хлорида.
В стерильной мерной колбе на 100 мл в части воды для инъекций растворяют 1,8 натрия хлорида, 0,22 глюкозы с влажностью 9%, 0,04 г калия хлорида, прибавляют 4 капли (0,2 мл) 20 %-ного раствора кальция хлорида и водой для инъекций доводят объем до 100 мл. Раствор анализируют, фильтруют во флакон, укупоривают стерильной резиновой пробкой, проводят контроль на механические примеси, обкатывают металлическим колпачком, проверяют герметичность укупорки и стерилизуют при 120 °С 8 минут, проводят вторичный контроль и оформляют к отпуску.
В другой мерной колбе на 100 мл готовят раствор натрия гидрокарбоната (технологию см. на с. 501). Условия стерилизации аналогичны солевому раствору с глюкозой. Перед применением растворы сливают в асептических условиях.
 2014-02-17
2014-02-17 1649
1649








