Приведенные выше растворы применяют при лечении больных острыми желудочно-кишечными инфекциями, сопровождающимися обезвоживанием, интоксикацией, ацидозом, дефицитом электролитов крови. В табл. 34 приведены составы наиболее часто применяющихся плазмозаменяющих жидкостей.
Раствор «Квартасоль». Бесцветная жидкость с рН = 8,1—8,9. Раствор готовят по общим правилам. При работе с натрия ацетатом следует использовать респиратор, резиновые перчатки, защитные очки. Во избежание потери углерода диоксида, образующегося при гидролизе натрия гидрокарбоната, растворение производят при температуре не выше 20 °С в закрытом сосуде, избегая взбалтывания. Раствор стерилизуют при 120 °С.
Жидкость Петрова. Для получения раствора, способного задерживаться в организме на длительный срок, профессором Петровым была предложена пропись гипертонического раствора, содержащего натрия, калия, кальция хлориды, воду для инъекций и 10 % консервированной крови человека. Кровь к солевому раствору добавляют в асептических условиях перед введением больному, нагревая раствор до 38 °С. Раствор вследствие гипертонической концентрации медленно выводится почками и дольше, чем изотонические растворы, задерживается в русле крови.
Полиглюкин — 6 %-ный раствор деполимеризованного декстрана в изотоническом растворе натрия хлорида. Препарат быстро повышает артериальное давление при острой кровопотере и длительно
Таблица 34
Составы плазмозамещающих жидкостей
Содержание входящих в раствор солей, г/л
| Название | натрия гидрок арбонат | натрия гидрофосфат | |||||||||
| раствора | натрия хлорид | калия хлорид | натрия ацетат | кальция хлорид | магния хлорид | магния сульфат | натрия фосфат | глюкоза | прочие добавки | ||
| Раствор Рингера | 9,0 | 0,2 | 0,2 | - | 0,2 | - | - | - | - | - | - |
| Раствор Рингера— | 9,0 | 0,2 | 0,2 | - | 0,2 | - | - | - | - | 1,0 | - |
| Локка | |||||||||||
| Раствор Тироде | 8,0 | 0,2 | 1,0 | - | 0,2 | 0,1 | - | 0,05 | - | 1,0 | - |
| Солевой инфузин | 8,0 | 0,2 | 0,8 | - | 0,25 | - | 0,05 | 0,138 | - | - | СО2 до рН |
| ЦОЛИПК1 | 6,0—6,4 | ||||||||||
| Жидкость ЛИПК2 | 15,0 | 0,2 | 0,1 | - | 0,2 | - | - | - | - | - | - |
| Раствор Атцлера— | 8,0 | 0,2 | 1,2 | - | 0,2 | 0,1 | - | - | - | - | 0,7 г гумми- |
| Лемана | арабика | ||||||||||
| Жидкость Петрова | 15,0 | 0,2 | - | - | 0,1 | - | - | - | - | - | 10 % крови |
| Серо-трансфузин | 7,5 | 0,2 | - | - | - | 0,1 | - | 0,052 | 0,476 | 10,0 | при приме- |
| ЦОЛИПК | нении смешивают с человеческой сывороткой в пропорции 4:1 | ||||||||||
| Трисоль | 6,0 | 1,0 | 4,0 | - | - | - | - | - | - | - | - |
| Ацесоль | 5,0 | 1,0 | - | 2,0 | - | - | - | - | - | - | - |
| Дисоль | 6,0 | - | - | 2,0 | - | - | - | - | - | - | - |
| Хлосоль | 4,75 | 1,5 | - | 3,6 | - | - | - | - | - | - | - |
| Квартасоль | 4,75 | 1,5 | 1,0 | 2,6 | - | - | - | - | - | - | - |
Солевой инфузин ЦОЛИПК, предложенный Центральным ордена Ленина институтом переливания крови (И. А. Федоров и П. С. Васильев). ЛИПК — Ленинградский институт переливания крови (И. Р. Петков и А. М. Филатов).
удерживает его на высоком уровне. Применяется как в чистом виде, так и в смеси с солевыми растворами. Выпускается в герметически укупоренных флаконах по 400 мл. Хранят при температуре от +10 до +20 °С. Замерзание полиглюкина не является противопоказанием к применению.
Реополиглюкин — 10 %-ный раствор частично гидролизованного декстрана в изотоническом растворе натрия хлорида. Препарат уменьшает агрегацию форменных элементов крови. Оказывает дезинток-сицирующее действие. Выпускается во флаконах по 400 мл. Хранят в сухом месте при температуре от +10 до +20 °С.
Многие заболевания и патологические состояния сопровождаются интоксикацией организма (отравление различными ядами, инфекционные заболевания, ожоги, острая печеночная и почечная недостаточность и др.). Для их лечения необходимы целенаправленные дезинтоксикационные растворы, компоненты которых должны связываться с токсинами и быстро выводить их из организма. К таким соединениям относятся поливинилпирролидон (ПВП) и спирт поливиниловый.
Растворы ПВП с молекулярной массой от 20 до 40 тысяч применяют как плазмозаменители в качестве компонента, обеспечивающего вязкость инфузионных растворов. Препараты с молекулярной массой выше 40 тысяч для введения в ток крови не применяются, так как длительно задерживаются в организме и могут накапливаться в селезенке, печени.
Препараты ПВП с молекулярной массой ниже 20 тысяч быстро выводятся из организма и применяются как дезинтоксицирующие средства. Из применяемых для этой цели препаратов можно отметить гемодез — водно-солевой раствор, содержащий 6 % низкомолекулярного ПВП и хлориды Na+, K+, Ca2+, Mg2+. Это прозрачная слегка желтоватая жидкость. Применяется для дезинтоксикации организма при токсических формах желудочно-кишечных заболеваний, особенно у детей (дизентерия, диспепсия), при ожоговой болезни, скарлатине, дифтерии и других инфекционных заболеваниях. Препарат связывает токсины и быстро выводит их через почки.
Близок по механизму действия к гемодезу полидез — 3 %-ный раствор низкомолекулярного поливинилового спирта в изотоническом растворе натрия хлорида. Вводится внутривенно капельно, являясь энергетическим средством, может вводиться с растворами глюкозы, гидролизатов белка и другими лечебными растворами.
Плазмозамещающие растворы, содержащие белки, используют как средства для парентерального питания: раствор гидролизина, гидролизат казеина, аминопептид, аминокровин, фибриносол и др.
К плазмозаменителям белкового происхождения относится же-латиноль — 8 %-ный раствор частично расщепленного пищевого желатина в изотоническом растворе натрия хлорида. Содержит ряд аминокислот (кроме триптофана). Это прозрачная жидкость янтарного цвета. Применяется в качестве плазмозамещающего средства при операциях, травматическом шоке, при подготовке к операции и для дезинтоксикации организма. Выпускают во флаконах разной вместимости. Хранят при температуре 4—6 °С. В случае выпадения осадка препарат применять нельзя.
Противошоковые растворы. Введение плазмозамещающих растворов, действие которых направлено на нормализацию кровообращения, оказалось недостаточно эффективным в борьбе с шоком. Для получения противошоковых растворов к плазмозамещающим жидкостям добавляют лекарственные вещества, способствующие повышению кровяного давления, нормализации функций центральной и вегетативной нервных систем, восстановлению химизма крови и тканей. К противошоковым жидкостям относятся глюкозо-спирто-вые растворы, так называемые стимуляторы, и растворы со снотворными и наркотическими веществами.
Противошоковые жидкости можно разделить на три группы:
— простые противошоковые растворы, содержащие соли, глюкозу и спирт этиловый;
— сложные противошоковые растворы, содержащие глюкозу, спирт этиловый, бромиды и наркотики;
— сложные противошоковые растворы, содержащие глюкозу, спирт этиловый, бромиды, наркотики, плазму крови.
Спирт обладает обезболивающим, снотворным действием, а также повышает окислительно-восстановительные процессы. Лечебный эффект глюкозо-спиртовых растворов усиливается добавлением к ним натрия бромида, морфина гидрохлорида, барбитала, уретана и других снотворных и наркотических веществ. Механизм действия противошоковых жидкостей сводится к нормализации процессов возбуждения и торможения в центральной нервной системе, устранению потока нервно-болевых ощущений, что достигается введением бромидов и наркотиков. Снотворные и наркотические вещества, вызывая сон, предохраняют клетки от истощения. Противошоковые растворы с изотонической концентрацией, как правило, быстро выводятся из кровяного русла, поднимают артериальное давление и увеличивают массу циркулирующей крови на очень короткий срок. Более эффективны в этом отношении противошоковые растворы с гипертонической концентрацией.
В соответствии с ранее приведенной классификацией к первой группе может быть отнесена противошоковая жидкость ЦОЛИПК по прописи П. А. Сельцовского, которая содержит: натрия хлорида 7,0 г, калия хлорида 0,2 г, магния сульфата 0,04 г, глюкозы 54,2 г, спирта 96 % 80 мл, жидкости Вейбеля 3,3 мл, воды до 1000 мл.
В противошоковых жидкостях второй группы лечебная эффективность глюкозо-спиртового сочетания усилена бромидами и наркотиками. В качестве примера может быть противошоковая жидкость Асратяна, которая отпускается в виде двух растворов.
Раствор А содержит: натрия хлорида 8,0 г, натрия бромида 0,75 г, натрия гидрокарбоната 0,6 г, воды для инъекций до 500 мл.
Раствор Б содержит: уретана 1,2 г, барбитала 0,15 г, кальция хлорида 1,5 г, глюкозы 17,0 г, спирта 96 % 15 мл, воды до 50 мл.
Перед употреблением оба раствора нагревают до 20—25 °С (не более) и смешивают непосредственно перед введением.
Противошоковый раствор А. Н. Филатова аналогично раствору Асратяна содержит кальция хлорид, глюкозу, спирт и барбитал, переносит стерилизацию и сохраняется в ампулах в течение длительного времени.
Противошоковые растворы третьей группы усложнены добавлением вязких компонентов. Например, в противошоковый раствор Белякова и Петрова входят: натрия бромид 1,0 г, кофеин 0,2 г, морфин 0,01 г, плазма 40 мл, синкол 400,0 г. Другой раствор этой группы — противошоковый раствор ЦОЛИПК содержит: спирта 96 % 50 мл, глюкозы 50,0 г, текодина 0,04 г, дефибринированной плазмы 200 мл и воды до 500 мл. Благодаря содержанию в этих растворах синкола (6 %-ный раствор гидролизованного декстрана в изотоническом растворе натрия хлорида) или плазмы, которые продолжительное время удерживаются в сосудистом русле, увеличивается масса циркулирующей крови. Слабая сторона этой группы растворов — отсутствие в них веществ, нормализующих нарушенный объем.
Приготовляют противошоковые растворы так же, как изотонические и плазмозамещающие растворы.
Добавление спирта в растворы для инъекций можно проводить двумя способами:
1. Необходимое количество спирта (в асептических условиях) добавляют к готовому простерилизованному раствору.
2. В случае приготовления растворов в ампулах (или герметически закрываемых флаконах) спирт вводят в раствор до стерилизации.
При приготовлении спиртовых растворов флаконы заполняются на 3/4 объема, содержимое флакона не должно соприкасаться с пробкой при стерилизации. Пробки не должны иметь проколов. Укупоренные под обкатку металлическими колпачками флаконы обязательно следует проверять на герметичность.
Спиртовые растворы целесообразно укупоривать пробками марки ИР-21 (бежевого цвета), ИР-119 (серого цвета). При укупорке пробками марки 25П (красного цвета) необходимо подкладывать под них специально обработанную пергаментную бумагу или нелакированный целлофан.
Жидкость Банайтиса.
Rp.: Solutionis Glucosi 25 % 65 ml
Natrii chloridi 0,5
Calcii chloridi 0,12
Spiritus aethylici 60 % 12 ml Sterilisa!
Da. Signa. Для внутривенного введения
Жидкость Банайтиса — это солевое плазмозамещающее средство, применяемое в легких случаях шока и при умеренной кровопотере.
Отвешивают 16,25 г глюкозы безводной, 0,5 г натрия хлорида и 0,12 г кальция хлорида. Доводят водой для инъекций до 65 мл фильтруют, добавляют 12 мл 60 % спирта и герметично укупоривают. Стерилизуют паром под давлением при температуре 120 °С в течение 8 минут.
Применение плазмозамещающих растворов имеет огромное значение для медицинской практики, так как их использование позволяет уменьшить количество донорской крови.
РАСТВОРЫ ДЛЯ ИНЪЕКЦИЙ НА НЕВОДНЫХ РАСТВОРИТЕЛЯХ
Rp.: Protargoli 2,0
Glycerini 100,0
Misce. Sterilisa!
Da. Signa. Для орошения голосовых связок
Вначале рассчитывают количество стерильной воды очищенной, необходимой для разведения «х.ч.» глицерина до плотности 1,225— 1,235. Неразведенный глицерин (98—100 %) стерилизуют горячим воздухом при 150 °С в течение часа или при 140 °С — 3 часа. Протаргол растирают в ступке с небольшим количеством охлажденного глицерина, затем растворяют при перемешивании в рассчитанном объеме воды, после чего добавляют полученный раствор к стерильному глицерину в асептических условиях. При необходимости раствор процеживают.
Rp.: Sulfuris praecipitati 1,0
Olei Persicorum 100,0
Misce. Sterilisa!
Da. Signa. Для внутримышечных инъекций
Масло персиковое (100,0 г) предварительно стерилизуют в сушильном шкафу при температуре 180 °С в течение 30 минут. В теплом масле растворяют серу очищенную (1,0 г) и раствор фильтруют в нагретом сушильном шкафу в стерильный флакон для отпуска, укупоривают и стерилизуют при 110 °С 30 минут. Раствор представляет собой прозрачную маслянистую жидкость желтого цвета.
Rp.: Solutionis Camphorae oleosae 20 % 100,0 Sterilisa!
Da. Signa. По 2 мл под кожу
Это масляный инъекционный раствор. Камфору (20,0 г) растворяют в теплом (40—45 °С) профильтрованном и стерилизованном (персиковом, абрикосовом или миндальном) масле (80,0 г). Фильтруют в нагретом сушильном шкафу в стерильный флакон для отпуска, укупоривают и стерилизуют при 110 °С 30 минут.
Суспензии для инъекций. Суспензии для инъекций должны иметь не только химическую, но и физическую стабильность. Физическая стабильность определяется способностью гетерогенных систем оставаться в высокодисперсном состоянии на протяжении установленного срока хранения. Поэтому в их состав, при необходимости, вводят стабилизаторы. Сложной технологической задачей при приготовлении суспензий для инъекций является выбор метода стерилизации, так как при высокой температуре в суспензиях может происходить укрупнение размера частиц дисперсной фазы. В связи с этим суспензии для парентерального применения, как правило, приготавливают из стерильных порошков (если они выдерживают стерилизацию) непосредственно перед введением (в асептических условиях). В промышленных условиях используют также методы стерилизации, которые обеспечивают физическую стабильность лекарственной формы. В настоящее время в виде суспензий для инъекций производятся кортизона ацетат 2,5 % во флаконах по 10 мл, гидрокортизона ацетат 2,5 % в ампулах по 2 мл и др.
Примером экстемпоральной прописи суспензий для парентерального применения может являться следующая:
Rp.: Streptocidi 6,0
Olei Persicorum 30,0 pro injectionibus
Misce. Da. Signa. Для внутримышечных инъекций
При нагревании взвесей происходит укрупнение дисперсной фазы. В связи с этим их готовят с использованием простерилизованных ингредиентов в асептических условиях.
В сухой стерильный флакон фильтруют 30,0 г масла персикового и стерилизуют в сушильном шкафу при 180—200 °С в течение 15— 30 минут. В стерильной ступке тщательно растирают 6,0 г стрептоцида (предварительно простерилизованного) с 30 каплями спирта этилового (трудноизмельчаемое вещество) до максимальной мелкости и в асептических условиях смешивают с 3,0 г (половинное количество от стрептоцида) масла стерильного до получения однородной взвеси. Далее смесь разбавляют оставшимся количеством масла и переносят в стерильный флакон с притертой пробкой.
Эмульсии для парентерального питания > Эмульсии для парентерального питания — это высокодисперсные гетерогенные системы, содержащие нейтральные жиры в водной среде.
Эмульсии для парентерального питания играют важную роль в организме: они включаются в обменные процессы, являясь при этом богатым источником энергии. По сравнению с другими препаратами они имеют более высокую калорийность при уменьшенном объеме жидкости, осмотическую неактивность, высокое содержание полиненасыщенных жирных кислот, малую степень выведения субстрата с мочой и калом.
Лекарственные препараты в форме жировых эмульсий не должны проявлять гемолитическую активность, токсичность и пироген-ность.
В медицинской практике наиболее часто используются такие жировые эмульсии: «Интралипид» (Швейцария), «Венолипид» (Япония) и др. Широкое применение находят эмульсии антигемолитического действия, содержащие фосфатидил-этаноламин; эмульсии на основе фторуглеродных соединений, используемые для переноса кислорода.
Отечественная фармацевтическая промышленность (Львовский НИИ гематологии и переливания крови) выпускает препарат «Ли-пидин», представляющий собой 20 % эмульсию подсолнечного масла, стабилизированную 1 % растительным фосфатидилхолином.
Оптимальный размер частиц в эмульсиях для парентерального питания должен быть не более 0,8—1 мкм. Получение эмульсий с заданной величиной частиц осуществляется с помощью методов механического и ультразвукового диспергирования.
В технологии эмульсий для парентерального питания важное значение имеет подбор количества эмульгаторов, порядок смешивания компонентов, рН системы и ее температура, выбор метода стерилизации.
Для приготовления жировых эмульсий используют жиры животного и растительного происхождения. Предпочтительнее использовать растительные масла (соевое, хлопковое, подсолнечное, кунжутное). В качестве эмульгаторов часто используют фосфолипиды, выделенные из яичного желтка и мозга крупного рогатого скота (фос-фатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, сфин-гомиелин). Эмульгаторы подбираются с учетом состава эмульсии и концентрации нейтральных жиров.
Термический метод стерилизации отрицательно сказывается на стабильности и сохранности препаратов. Более приемлемым является метод стерилизации ультрафильтрацией через мембранные фильтры.
Технологические стадии приготовления эмульсий для парентерального питания более подробно рассматриваются в курсе промышленной технологии лекарств.
ХРАНЕНИЕ И ОТПУСК ИНЪЕКЦИОННЫХ ЛЕКАРСТВЕННЫХ ФОРМ
Хранить приготовленные лекарственные препараты для инъекционного введения необходимо при условиях, которые исключают возможность их загрязнения. Места хранения должны быть отдалены от лифтов, санузлов, мест приема и распаковки товаров, использованной тары и оборудованные столами или стеллажами.
Отпуск лекарственных препаратов из аптек лечебно-профилактическим учреждениям необходимо проводить только при соблюдении режимов, исключающих их загрязнение в процессе транспортировки, то есть в чистую маркированную тару (ящики, легко поддающиеся дезобработке).
Приготовленные в аптеках растворы для инъекций, укупоренные «под обкатку» в соответствии с приказом № 96 МЗ СССР от 3.04.91 г (приложение 2), имеют срок годности от 7 до 30 суток, все остальные — не более 2 суток.
Структурно-логическая схема технологии и контроля качества растворов для инъекций приведена на схеме 17.
ИНЪЕКЦИОННЫХ ЛЕКАРСТВЕННЫХ ФОРМ
Проводимые исследования в области совершенствования технологии инъекционных лекарственных форм направлены на повышение эффективности и качества продукции, что требует решения основных проблем, — это стабилизация, обеспечение отсутствия механических примесей в препаратах, оптимизация процесса получения и его аппаратурного оснащения.
В настоящее время широкое распространение получил химический метод стабилизации, предусматривающий прибавление различных вспомогательных веществ-стабилизаторов к лекарственным препаратам, что не является оптимальным способом получения стабильных лекарств с биологической точки зрения. Заслуживает внимания физический, вернее технологический способ стабилизации, позволяющий получить стойкие препараты без прибавления каких-либо вспомогательных веществ-стабилизаторов. С биологической точки зрения физический способ стабилизации наиболее рациональный и требует значительного расширения исследований в этом направлении.
Так, в США широко развивается производство замороженных ин-фузионных растворов (цефалоспориновых антибиотиков и антибиотиков других групп). Эти растворы готовят в 0,9 %-ном растворе натрия хлорида или 5 %-ном растворе глюкозы и выпускают в специальных полимерных контейнерах вместимостью 50 или 100 мл.
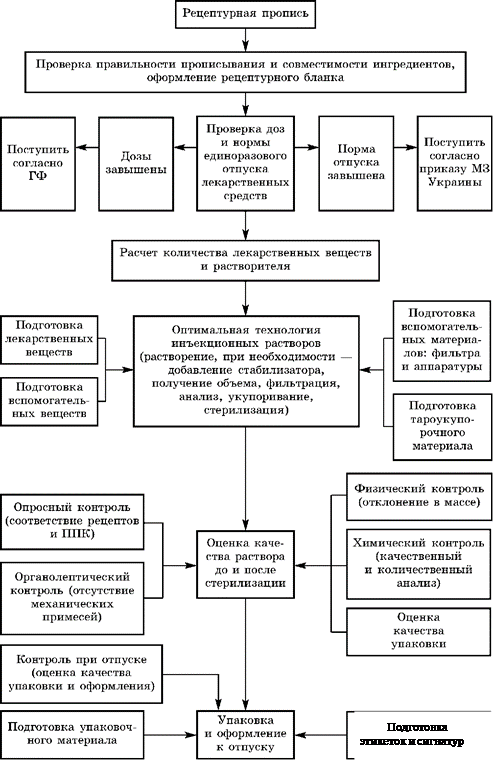
СТРУКТУРНО-ЛОГИЧЕСКАЯ СХЕМА ТЕХНОЛОГИИ И КОНТРОЛЯ КАЧЕСТВА РАСТВОРОВ ДЛЯ ИНЪЕКЦИЙ
Срок годности таких растворов 6 месяцев при хранении при температуре не выше минус 20 °С.
Одним из направлений совершенствования технологии инфузи-онных препаратов в отношении обеспечения стабильности является разработка методов создания водных растворов из труднорастворимых субстанций. Особое внимание привлекают комбинированные, инфузионные и полиионные препараты, требующие изучения вопросов совместимости и стабильности. Перспективным является производство концентрированных растворов (концентратов), порошков и лиофилизированных лекарственных форм для инъекций.
Концентраты для внутривенных инъекций представляют собой стерильные растворы, предназначенные для применения после разведения до указанного объема соответствующей жидкостью. Порошки и лиофилизированные лекарственные формы при встряхивании с указанным объемом соответствующей стерильной жидкости образуют прозрачный, свободный от механических частиц раствор.
Эти лекарственные формы должны соответствовать всем требованиям, предъявляемым к инъекционным препаратам.
В настоящее время развивается направление применения аминокислотных инфузионных растворов в сочетании с растворами глюкозы, жировыми эмульсиями.
Важной проблемой является оптимизация технологического процесса получения инъекционных лекарственных форм и совершенствования оборудования. Процесс получения, фильтрования, разлива во флаконы, укупорки инъекционных препаратов необходимо проводить в условиях «чистых комнат». Решение проблемы обеспечения отсутствия механических примесей в инъекционных препаратах осуществляется созданием эффективных фильтров, а также совершенствованием методов контроля качества фильтрата. Контроль фильтрата и раствора во флаконах в основном осуществляется визуально. За рубежом используются системы автоматического контроля чистоты растворов (Япония). В нашей стране разработана установка для контроля чистоты фильтрата по частичкам величиной 2—5 мкм и более.
Комплексное решение основных проблем с учетом других факторов, влияющих на стабильность препаратов, позволит получить стабильные инъекционные лекарственные формы высокого качества.
Глава 26
ГЛАЗНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ
ХАРАКТЕРИСТИКА ГЛАЗНЫХ
ЛЕКАРСТВЕННЫХ ФОРМ
В практической офтальмологии для лечения глазных заболеваний применяют инстилляцию растворов, закладывание в конъюнк-тивальный мешок мазей, глазных пленок, таблеток, ламелей, инъекционное введение лекарственных веществ, а также с помощью контактных линз и электрофореза. Перечисленным путям введения офтальмологических лекарственных препаратов соответствует и многообразие лекарственных форм: твердых, жидких, мягких и газообразных.
К твердым глазным лекарственным формам относятся: таблетки, ламели, карандаши, присыпки, глазные лекарственные пленки; к газообразным — аэрозоли (глазные спреи); к мягким — мази гомогенные и гетерогенные; к жидким — истинные водные и масляные растворы, растворы ВМС, коллоидные растворы, эмульсии и суспензии. Они применяются в виде глазных капель, примочек, промываний, растворов для инъекций и электрофореза.
Вид лекарственной формы в офтальмологической фармакотерапии определяется целым рядом взаимосвязанных факторов: состоянием патологического процесса, общими показателями состояния организма больного, наличием соответствующих травматических повреждений органа зрения, степенью проницаемости гематоофталь-мологического барьера, физико-химическими свойствами лекарственных веществ, особенностями фармакологического действия лекарственных и вспомогательных веществ и др. Значительная роль в процессах активизации или ингибирования действия лекарственных веществ принадлежит и таким факторам, как величина рН, осмотическое давление раствора, молекулярная масса веществ-носителей и т. п. Для приготовления глазных лекарственных форм высокого качества необходимо учитывать указанные факторы.
В экстемпоральной рецептуре аптек наиболее часто приготовляются глазные капли, примочки и мази.
ГЛАЗНЫЕ КАПЛИ (GUTTAE OPHTALMICAE)
Ш Глазные капли — это жидкие лекарственные формы, представляющие собой водные или масляные растворы, а также тончайшие суспензии лекарственных веществ, предназначенные для инстилляции в глаз.
Наносят их на слизистую оболочку глаза с помощью стерильной глазной пипетки. Глазные капли прописывают в небольших количествах (5—10 мл) с расчетом их использования в течение непродолжительного времени.
В виде глазных капель применяют растворы различных лекарственных веществ. Многие из них нестойки и изменяются или разрушаются под влиянием высокой температуры, солнечного света, микрофлоры и других факторов.
Особенно часто назначают глазные капли с витаминами (кислотой аскорбиновой, тиамина бромидом, рибофлавином), солями алкалоидов (атропина сульфатом, пилокарпина гидрохлоридом и др.), антибиотиками (бензилпенициллином, левомицетином, неомицином и др.), цинка сульфатом, кислотой борной, натрия-сульфацилом. В настоящее время насчитывается около 80 лекарственных веществ, применяемых в глазной практике, и значительное количество разнообразных их сочетаний.
Требования, предъявляемые к глазным каплям. Низкое качество глазных капель и, в первую очередь, загрязнение их микроорганизмами может вызвать тяжелые последствия вплоть до потери зрения.
В связи с этим требования, предъявляемые к глазным каплям, должны быть аналогичны тем, которые предусмотрены для инъекционных растворов: стерильность, отсутствие механических примесей, стабильность, комфортность, (изотоничность, оптимальное значение рН), пролонгированность действия.
Стерильность. Глазные капли, а также концентрированные растворы, применяемые для их приготовления, должны приготовляться в асептических условиях с последующей стерилизацией.
Способ стерилизации глазных капель зависит от устойчивости лекарственных веществ в растворах к температурному воздействию. По этому признаку лекарственные вещества можно разделить на три группы:
1.Лекарственные вещества, растворы которых могут подвергаться тепловой стерилизации без добавления стабилизаторов (кислота борная, кислота никотиновая, натрия хлорид, фурацилин и др.).
2. Лекарственные вещества, растворы которых могут подвергаться тепловой стерилизации после добавления стабилизаторов (суль-фацил-натрия, этилморфина гидрохлорид, физостигмина салицилат, ПАС-натрий, салюзид растворимый и др.).
З.Лекарственные вещества, растворы которых не выдерживают тепловой стерилизации (протаргол, колларгол, лидаза, химопсин, трипсин, пенициллин и др.) и приготавливаются асептически без последующей стерилизации.
 2014-02-17
2014-02-17 1122
1122








