Термодинамическая система в каждом состоянии обладает энергией Е, включающей внешнюю энергию Е внеш, состоящую из энергии движения системы как целого и потенциальной энергии системы в поле внешних сил, и внутреннюю энергию U.
Если движение системы как целого отсутствует и изменение ее потенциальной энергии равно нулю, то полная энергия системы будет равняться ее внутренней энергии. Внутренняя энергия состоит из энергии разных видов движения и взаимодействия входящих в систему частиц, а именно: кинетической энергии U кин поступательного и вращательного движения молекул и колебательного движения атомов и потенциальной энергии взаимодействия между молекулами.
Кинетическая энергия движения молекул – однозначная функция температуры Т. Потенциальная энергия сил взаимодействия зависит от среднего расстояния между молекулами, т.е. от объема V газа. Поскольку Т и V являются параметрами состояния, то внутренняя энергия также есть функция состояния рабочего тела. Для любых двух параметров, определяющих это состояние, можно написать:
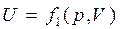 ;
; 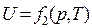 ;
; 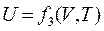 . (2.7)
. (2.7)
Внутренняя энергия единицы массы вещества u = U/M называется удельной внутренней энергией (Дж/кг).
В технике важно не абсолютное значение внутренней энергии, а ее изменение в термодинамических процессах. Поскольку внутренняя энергия – параметр состояния, то ее изменение не зависит от промежуточных состояний рабочего тела (от пути процесса), а определяется начальным и конечным состоянием системы. Для состояний 1 и 2 можно записать
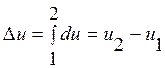 . (2.8)
. (2.8)
Если начальное и конечное состояния совпадают, то для кругового процесса
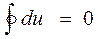 . (2.9)
. (2.9)
Внутренняя энергия идеального газа, у которого силы взаимодействия между молекулами отсутствуют, зависит только от температуры, и ее изменение ∆u при изменении Т на 1 градус равно молярной теплоемкости при постоянном объеме:
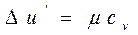 . (2.10)
. (2.10)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг)
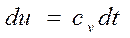 . (2.11)
. (2.11)
В теплотехнических расчетах обычно требуется знать изменение внутренней энергии Δu, а не ее абсолютное значение; поэтому начало отсчета (0 К или 0°С) для конечного результата (Δu) не имеет значения.
Интегрируя последнее уравнение в пределах t1 – t2 получаем:
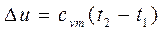 , (2.12)
, (2.12)
где 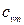 – средняя массовая теплоемкость при постоянном объеме в пределах t1 – t2.
– средняя массовая теплоемкость при постоянном объеме в пределах t1 – t2.
Для М кг газа
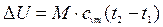 . (2.13)
. (2.13)
Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоемкости при постоянном объеме на разность температур газа.
 2014-02-09
2014-02-09 1298
1298
