Теплоемкостью называется количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой–либо количественной единицы его на 1о С.
В зависимости от выбранной количественной единицы вещества различают:
мольную теплоемкость µс – кДж/(кмоль · К),
массовую теплоемкость с – кДж/(кг · К),
объемную теплоемкость с' – кДж/(м3 · К).
Как известно, 1 м3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенного в 1 м3 его при нормальных условиях
[рн = 101325 Па (760 мм рт.ст.) и Тн = 273 К (tн = 0 °С)].
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой–либо из них. Удобнее всего иметь величину мольной теплоемкости.
Тогда массовая теплоемкость 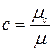 (2.18)
(2.18)
объемная теплоемкость 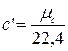 , (2.19)
, (2.19)
где 22,4 м3/кмоль – объем 1 кмоля всех идеальных газов при нормальных условиях.
Объемная и массовая теплоемкости связаны между собой зависимостью
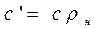 , (2.20)
, (2.20)
где 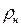 – плотность газа при нормальных условиях. Плотность газа при нормальных условиях определяется из равенства
– плотность газа при нормальных условиях. Плотность газа при нормальных условиях определяется из равенства
|
|
|
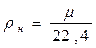 кг/м3. (2.21)
кг/м3. (2.21)
Теплоемкость газа зависит от температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q – количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то
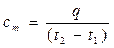 (2.22)
(2.22)
представляет собой среднюю теплоемкость в пределах t1…t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью.
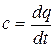 . (2.23)
. (2.23)
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме (по изохоре);
2) изменение состояния при постоянном давлении (по изобаре).
Обоим этим случаям соответствуют различные значения теплоемкостей.
В таблице 2.1 приведена классификация различных видов теплоемкостей в зависимости от единиц количества веществ (массовые, объемные и мольные), температуры (истинные и средние) и процесса (изохорные и изобарные).
Таблица 2.1 – Классификация теплоемкостей
| Теплоем– кость | Массовая кДж/(кг · К) | Объемная кДж/(м3 · К) | Мольная кДж/(кмоль · К) | |||
| истин. | средняя | истин. | средняя | истин. | средняя | |
| Изохорная | сv | сvm | 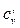 | 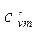 | µсv | µсvm |
| Изобарная | ср | сpm | 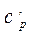 | 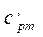 | µср | µсpm |
Еще в 1842 г. один из основоположников закона сохранения и превращения энергии Ю.Майер установил, что между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость (закон Майера):
|
|
|
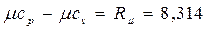 , кДж/(моль · К) (2.24)
, кДж/(моль · К) (2.24)
или
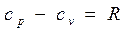 (2.25)
(2.25)
Физический смысл этой зависимости легко уяснить. Если для нагревания 1 моля (или 1 кг) газа в цилиндре над поршнем на 1 градус при постоянном объеме, т.е. при закрепленном поршне, надо затратить количество теплоты сv, то при постоянном давлении к этому количеству теплоты добавится работа R µ (или R), которую будет совершать расширяющийся газ, толкая освобожденный поршень.
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (таблица 2.2).
Отношение теплоемкостей при постоянных давлении и объеме обозначают к и называют коэффициентом Пуассона, или показателем адиабаты
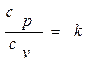 . (2.26)
. (2.26)
Таблица 2.2 – Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с = const)
| Газы | Теплоемкость, кДж/(моль·К) | |
| µсv | µср | |
| Одноатомные | 12,56 | 20,93 |
| Двухатомные | 20,93 | 29,31 |
| Трех– и многоатомные | 29,31 | 37,68 |
Согласно молекулярно–кинетической теории газов:
для одноатомных газов k = 1,667,
для двухатомных k = 1,4,
для трехатомных k = 1,29.
Теплоемкость газов изменяется с изменением температуры, при чем эта зависимость имеет криволинейный характер. В таблице 2.2 приведены теплоемкости для наиболее часто встречающихся в теплотехнических расчетах двух– и трехатомных газов.
При пользовании таблицами значения истинных теплоемкостей, а также средних теплоемкостей в пределах от 0° до t берут непосредственно из этих таблиц, причем в необходимых случаях производится интерполирование.
Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2,
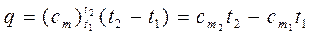 , (2.27)
, (2.27)
где 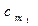 и
и 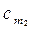 – соответственно средние теплоемкости в пределах 0°С – t1 и 0°С – t2.
– соответственно средние теплоемкости в пределах 0°С – t1 и 0°С – t2.
Из этой формулы легко получить выражение для определения количества теплоты, затрачиваемой в процессе при постоянном объеме и в процессе при постоянном давлении, т. е.
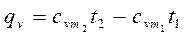 ; (2.28)
; (2.28)
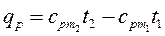 . (2.29)
. (2.29)
Если в процессе участвуют М кг или VН м3 газа, то
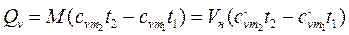 ; (2.30)
; (2.30)
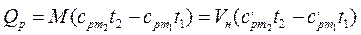 . (2.31)
. (2.31)
 2014-02-09
2014-02-09 13229
13229
