Главная особенность квантово-механического описания электрона состоит в том, что электрон, оставаясь частицей, подобен волне (принцип де Бройля).
При этом его пространственные координаты и величину импульса невозможно определить с высокой точностью, т.е. невозможно предсказать направление, если известно, что в данный момент он расположен в какой-либо области пространства.
Поведение электрона теряет детерминированный характер, т.е. если в некоторый момент времени частица находилась в ограниченной области пространства, то в будущем невозможно достоверно предсказать ее местонахождение. Можно говорить лишь о распределении частиц в пространстве, о вероятности обнаружить ее в заданном месте.
Волновая функция – это функция, которая задает вероятностное статистическое описание местонахождения электрона в пространстве.
В общем случае уравнение Шрёдингера:
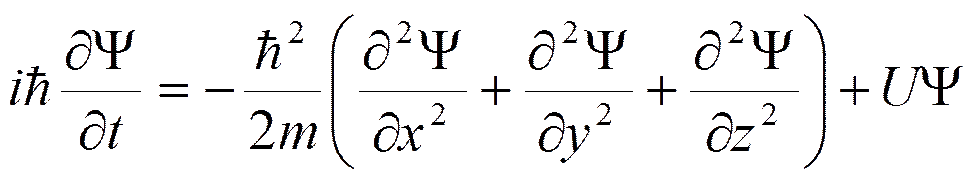
где
m - масса частицы,
U - потенциал поля, в котором движутся частицы
Вероятность обнаружения частицы в элементе объема
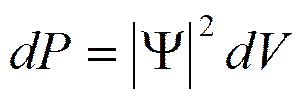 ,
,
где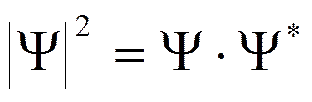
Если проинтегрировать это выражение по всему объему, получим условие нормировки уравнения Шредингера:
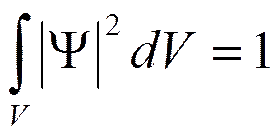
Если U не зависит от времени, то решение этого уравнения можно записать в виде
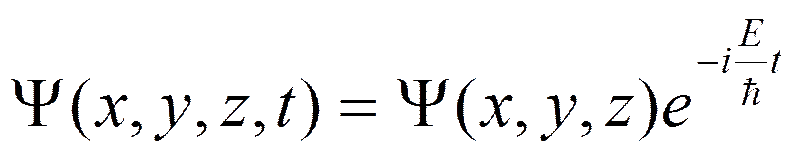
А стационарное уравнение Шредингера (не зависящее от времени) примет вид
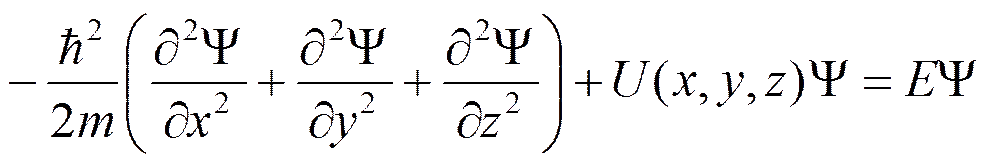
 2014-02-18
2014-02-18 560
560







