Рис. 96. Цинковая концентрационная цепь: М – солевой мостик, содержащий хлорид калия
Рис. 94. Схема медно-цинкового гальванического элемента
Каждый электрод состоит из металлической пластинки, опущенной в раствор соли: ZnSO4 и CuSO4, соответственно.
Растворы солей отделены друг от друга пористой перегородкой, сквозь которую легко могут проходить ионы металлов и SO42-. Часто вместо пористой перегородки используют «солевой мостик» – стеклянную изогнутую трубку, заполненную насыщенным раствором KCl (рис. 95). В этом случае электроды не контактируют друг с другом, каждый из них находится в отдельном сосуде, которые соединяются с помощью солевого мостика.

Рис. 95. Схема медно-цинкового элемента с солевым мостиком: 1 – цинковая пластинка; 2 – медная пластинка; 3 – солевой мостик
При этом на цинковом электроде происходит процесс окисления:
Zn0 – 2ē = Zn2+,
в результате которого ионы цинка с пластинки переходят в раствор. Избыточные электроны по металлическому проводнику с цинковой пластинки переходят на медную и восстанавливают содержащиеся в растворе ионы Cu2+
Cu2+ + 2ē = Cu0,
которые в виде нейтральных атомов оседают на пластинке. Остающиеся свободные сульфат-ионы медного электрода и появившиеся в избытке ионы Zn2+ цинкового электрода через пористую перегородку или солевой мостик перемещаются навстречу друг другу. Таким образом, в цепи осуществляется перенос электрических зарядов и возникает электрический ток.
В этом элементе электрическая энергия получается в результате протекания химической реакции
Zn + CuSO4 = Cu + ZnSO4
Основной характеристикой гальванического элемента является электродвижущая сила (э.д.с.), от которой зависит сила тока в цепи. Она равна разности электродных потенциалов
э.д.с. = Е2 – Е1
где Е1 и Е2 – соответственно, потенциал анода и катода.
Для гальванического элемента Якоби-Даниэля электродвижущая сила равна
э.д.с. = ЕCu – EZn
Чем выше значение э.д.с. элемента, тем больше сила тока в его цепи.
Согласно уравнению Нернста, потенциал медного и цинкового электродов рассчитывается по формулам:
ECu = ECu0 + 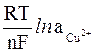
EZn = EZn0 + 
Вычитая второе уравнение из первого получим выражение для расчета э.д.с. медно-цинкового гальванического элемента
э.д.с. = ECu0 – EZn0 + 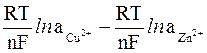 =
=
= ECu0 – EZn0 + 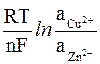
Для любого другого элемента, составленного из двух металлических электродов, и в основе работы которого лежит химическая реакция, электродвижущая сила может быть вычислена по формуле:
э.д.с. = E20 – E10 + 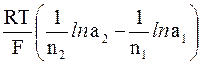
где Е20 и Е10 – стандартные электродные потенциалы, соответственно, катода и анода; n2 и n1 – величины зарядов ионов, участвующих в полуреакциях, которые протекают на катоде и аноде; а2 и а1 – активности ионов металла в растворах у катода и анода, соответственно).
Для температуры 298K, при подстановке значений констант R и F и при переходе от натурального логарифма к десятичному наше уравнение запишется иначе:
э.д.с. = E20 – E10 + 0,059 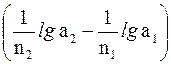
Гальванические элементы можно обозначать в виде схемы. Слева обычно приводится электрод или полуэлемент с меньшим значением электродного потенциала (анод), а справа – с большим значением электродного потенциала (катод).
При записи электродов сперва указывают твердую фазу (например, металл в случае металлического или редокс-электрода), а затем – вещества, растворенные в жидкой фазе. Фазы отделяются друг от друга одной вертикальной чертой. Если в одной фазе содержится несколько компонентов, то они записываются через запятую.
Границу раздела между растворами двух электродов изображают пунктирной вертикальной чертой или двумя сплошными линиями ½½ (если растворы отделяются друг от друга солевым мостиком).
В соответствии с вышеизложенными правилами, схема элемента Якоби-Даниэля выглядит следующим образом:
Zn ½ ZnSO4 ½½ CuSO4 ½ Cu
Гальванический элемент может быть составлен и из двух редокс-электродов, имеющих разное значение редокс-потенциала. Такие элементы называются иначе окислительно-восстановительными гальваническими элементами. Они тоже относятся к химическим гальваническим элементам, т.к. в основе их действия лежит протекание химической реакции.
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным. Он может состоять из двух одинаковых металлических электродов, погруженных в растворы одной и той же соли, но с различной концентрацией (активностью) ионов металла (рис. 96), например:
Zn ½ ZnSO4 ½½ ZnSO4 ½ Zn или Ag ½ AgNO3 ½½ AgNO3 ½ Ag
a1 a2 a1 a2
a1 < a2

Электрод, находящийся в более разбавленном растворе, растворяется, его ионы переходят в раствор:
Cu – 2ē ® Cu2+
Ag – ē ® Ag+
Сам электрод при этом заряжается отрицательно.
На электроде, погруженном в более концентрированный раствор, наоборот, осаждаются ионы металла, и он заряжается положительно. Таким образом, на обоих электродах протекают процессы, приводящие к выравниванию концентрации ионов металла в растворах.
Потенциалы электродов при этом равны:
E1 = E0 + 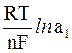 ; E2 = E0 +
; E2 = E0 + 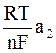
Вычитая первое уравнение из второго, получим формулу для подсчета э.д.с. с концентрационного элемента:
э.д.с. = E2 – E1 = 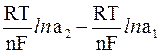
или
э.д.с. = 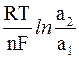
Концентрационный элемент будет работать до тех пор, пока активности ионов металлов в обоих растворах не сравняются; при а1 = а2 его э.д.с. будет равна 0.
 2014-02-09
2014-02-09 1670
1670







