7.1. Цель и задачи работы:
Изучить кондуктометрический метод анализа. Установить зависимость удельной и эквивалентной электропроводности от концентрации раствора. Изучить закон разбавления Оствальда, определить константу диссоциации слабого электролита. Установить, зависят ли степень диссоциации и константа диссоциации от концентрации раствора.
7.2. Объекты и средства исследования: дистиллированная вода, уксусная (муравьиная, щавелевая и т.п.) кислота, мерные колбы на 100 мл, химический стакан на 100 мл, кондуктометр.
7.3. Теоретические сведения.
Известно, что для слабых электролитов зависимость константы диссоциации от концентрации электролита выражается законом разбавления Оствальда:
 (1), где
(1), где
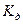 - константа диссоциации слабого электролита,
- константа диссоциации слабого электролита,
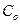 - исходная концентрация,
- исходная концентрация,
 - степень диссоциации.
- степень диссоциации.
Если определить степень диссоциации, то легко можно вычислить Кд. Метод определения степени диссоциации основан на измерениях электропроводности растворов.
Удельной электропроводностью раствора (χ) называется электропроводность объема жидкости, заключенного между двумя параллельными электродами, расстояние между которыми l = 1 м, а площадь поверхности каждого электрода S = 1 м2.
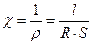 (2), где
(2), где
 - сопротивление, Ом,
- сопротивление, Ом,
 - удельное сопротивление, Ом·м,
- удельное сопротивление, Ом·м,
 - расстояние между электродами, м
- расстояние между электродами, м
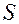 - площадь поверхности каждого электрода, м2
- площадь поверхности каждого электрода, м2
Таким образом, единица измерения χ выразится через Ом-1·м-1 или См·м-1.
Удельная электропроводность сначала возрастает с разбавлением раствора в результате увеличения степени диссоциации, затем, пройдя через максимум, уменьшается, так как число молекул, а, следовательно, и ионов в единице объема уменьшается.
Другая форма выражения электропроводности – эквивалентная электропроводность (λ). Эквивалентной электропроводностью называют электропроводность такого объема раствора, в котором содержится один моль эквивалентов растворенного вещества.
Связь между удельной (χ) и эквивалентной (λ) электропроводностью выражается формулой:
 (3)
(3)
таким образом, единицы измерения эквивалентной электропроводности: См·м2/моль. Так как в нашем кондуктометре объем раствора, заключенного между электродами 1 мл, то

 (при Сн = 1моль/л), а
(при Сн = 1моль/л), а 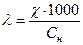 (4)
(4)
Эквивалентная электропроводность монотонно увеличивается с разбавлением раствора вследствие роста числа ионов и достигает предельного значения  при полной диссоциации (α=1). Величину
при полной диссоциации (α=1). Величину  находят экстраполяцией измеренных значений
находят экстраполяцией измеренных значений  на нулевую концентрацию (
на нулевую концентрацию ( - эквивалентная электропроводность электролита при концентрации С).
- эквивалентная электропроводность электролита при концентрации С).
Кроме того, эквивалентная электропроводность равна сумме подвижностей ионов*), на которые диссоциирует данный электролит:
 (5)
(5)
Таким образом, из экспериментальных данных можно рассчитать степень диссоциации  при данной концентрации электролита:
при данной концентрации электролита:
 , при
, при 

 (6)
(6)
Затем рассчитывают Кд по формуле  (7)
(7)
подставив 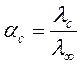 в выражение закона разбавления Оствальда (1).
в выражение закона разбавления Оствальда (1).
7.4. Программа работы
7.4.1. Приготовить 100 мл раствора слабого электролита с концентрацией 0,1н. Затем, отбирая пипеткой по 50 мл раствора, приготовить методом последовательного разбавления в мерных колбах на 100 мл несколько растворов с разными концентрациями (минимальная концентрация ~ 10-5 моль/л).
7.4.2. В стакан для определения электропроводности налить 50 мл раствора с максимальной концентрацией и, опустив в него кондуктометр, измерить электропроводность. Измерения повторить для всех растворов в порядке уменьшения концентрации. Опытные и расчетные данные записать в таблицу.
Таблица 7.1
Расчетно-экспериментальные данные
| № измерения | Концентрация раствора, моль/л | χ, См·м-1 | λ, См·м2/моль |  | Кд |
Привести подробно все расчеты. Сделать вывод.
*)Примечание:  ;
;  ;
; 
Таблица 7.2
Константы диссоциации кислот (250С)
| Кислота | Формула | К a | рК a |
| Азотистая | HNO2 | 5,1·10-4 | 3,40 |
| Борная | Н3ВО3 | К1 = 5,8·10-10 | 9,24 |
| К2 = 1,8·10-13 | 12,74 | ||
| К3 = 1,6·10-14 | 13,80 | ||
| Бромноватистая | HBrO | 2,5·10-9 | 8,70 |
| Иодноватистая | НIO | 2,3·10-11 | 10,64 |
| Кремниевая | H2SiO3 | К1 = 2,2·10-10 | 9,66 |
| К2 = 1,6·10-12 | 11,80 | ||
| Муравьиная | НСООН | 1,8·10-4 | 3,74 |
| Мышьяковая (орто) | H3AsO4 | К1 = 5,98·10-3 | 2,22 |
| К2 = 1,05·10-7 | 6,98 | ||
| К3 = 3,89·10-12 | 11,41 | ||
| Селенистая | H2SeO3 | К1 = 3,5·10-3 | 2,46 |
| К2 = 5,0·10-8 | 7,30 | ||
| Селеновая | H2SeO4 | К2 = 1,3·10-2 | 1,89 |
| Серная | H2SO4 | К2 = 1,2·10-2 | 1,92 |
| Сернистая | H2SO3 | К1 = 1,6·10-2 | 1,80 |
| К2 = 6,3·10-8 | 7,20 | ||
| Сероводородная | H2S | К1 = 6,0·10-8 | 7,20 |
| К2 = 1,0·10-14 | 14,00 | ||
| Тиосерная | H2S2O3 | К1 = 2,5·10-1 | 0,60 |
| К2 = 1,9·10-2 | 1,72 | ||
| Угольная | H2СO3 | К1 = 4,5·10-7 | 6,35 |
| К2 = 4,7·10-11 | 10,33 | ||
| Уксусная | СН3СООН | 1,7·10-5 | 4,76 |
| Фосфорноватистая | Н3РО2 | 8,0·10-2 | 1,10 |
| Фосфорная (орто) | Н3РО4 | К1 = 7,6·10-2 | 1,12 |
| К2 = 6,2·10-8 | 7,20 | ||
| К3 = 4,2·10-13 | 12,38 | ||
| Фосфорная (мета) | НРО3 | 2,5·10-3 | 2,60 |
| Фтористоводородная | НF | 6,8·10-4 | 3,17 |
| Хлорноватистая | HСlO | 5,0·10-8 | 7,30 |
| Цианистоводородная | HCN | 6,2·10-10 | 9,20 |
| Щавелевая | Н2С2О4 | К1 = 5,6·10-2 | 1,25 |
| К2 = 5,4·10-5 | 4,27 |
Таблица 7.3
Константы диссоциации оснований (250С)
| Основание | Формула | К b | рК b |
| Алюминия гидроксид | Al(OH)3 | К3 = 1,38·10-9 | 8,86 |
| Аммония гидроксид | NH4OH | 1,79·10-5 | 4,75 |
| Бериллия гидроксид | Be(OH)2 | K2 = 5,00·10-11 | 10,30 |
| Железа (II) гидроксид | Fe(OH)2 | K2 = 2,30·10-7 | 6,64 |
| Железа (III) гидроксид | Fe(OH)3 | K3 = 2,00·10-12 | 11,70 |
| Кадмия гидроксид | Cd(OH)2 | K2 = 5,00·10-3 | 2,30 |
| Кобальта (II) гидроксид | Со(ОН)2 | K2 = 4,00·10-5 | 4,40 |
| Кобальта (III) гидроксид | Со(ОН)3 | K3 = 7,00·10-13 | 12,15 |
| Магния гидроксид | Mg(OH)2 | K2 = 2,50·10-3 | 2,60 |
| Марганца (II) гидроксид | Mn(OH)2 | K2 = 5,00·10-4 | 3,30 |
| Меди (II) гидроксид | Cu(OH)2 | K2 = 3,40·10-7 | 6,47 |
| Никеля гидроксид | Ni(OH)2 | K2 = 8,71·10-6 | 5,06 |
| Свинца гидроксид | Pb(OH)2 | K1 = 9,60·10-4 | 3,02 |
| K2 = 3,00·10-8 | 7,52 | ||
| Серебра гидроксид | AgOH | 5,00·10-3 | 2,30 |
| Хрома (III) гидроксид | Cr(OH)3 | K3 = 1,59·10-8 | 7,80 |
| Цинка гидроксид | Zn(OH)2 | K1 = 4,40·10-5 | 4,35 |
| K2 = 2,00·10-9 | 8,70 |
 2017-11-01
2017-11-01 2515
2515
