Пояснения. Рассчитанную кривую титрования вычерчивают на миллиметровой бумаге (возможен вариант компьютерного оформления) в координатах рН = f [ V (NaOH)] (рис.1). На графике должны быть указаны скачок титрования, точка эквивалентности (ТЭ), линия нейтральности, интервалы перехода окраски двух индикаторов и значения показателей титрования для них (рТ).
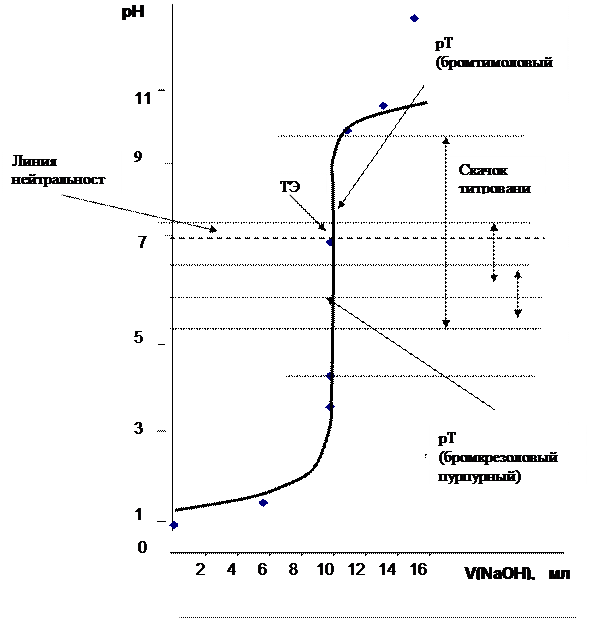 |
Рис. 1 Теоретическая кривая титрования 10 мл 0,1 М раствора HCl 0,1 М раствором NaOH
2. Построение кривой титрование раствора сильного основания раствором сильной кислоты
Задание. Рассчитать и построить кривую титрования 10 мл 0,1 М раствора NaOH.
Титрант: раствор HCl. 0,1 M.
Пояснения: Кривую титрования строят по расчетным точкам. Расчетные точки должны соответствовать следующим этапам титрования:
1. Начальная точка (рассчитывается рН до начала титрования, то есть рН титруемого раствора. В данном случае это 0,1М раствор NaOH. Поскольку гидрооксид натрия NaOH – сильный электролит (диссоциирует на ионы полностью 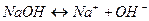 ), то
), то 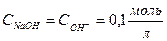 )
)
2. Область до точки эквивалентности (в процессе титрования концентрация NaOH уменьшается, а в растворе образуется NaCl, соль NaCl образована сильной кислотой и сильным основанием, в водном растворе гидролизу не подвергается и поэтому на рН раствора влиять не будет. рН раствора в ходе титрования до т.Э. будет зависеть от концентрации NaOH. Сколько моль титранта прибавили, на столько моль уменьшиться содержание гидрооксида натрия)
3. Точка эквивалентности (ТЭ) (в точке эквивалентности все количество NaOH будет полностью оттитровано HCl, и в растворе будут только находиться продукты их взаимодействия NaCl и H2O, как уже говорилось выше, NaCl - соль образована сильной кислотой и сильным основанием, в водном растворе гидролизу не подвергается и поэтому на рН раствора влиять не будет, поэтому рН раствора будет зависеть от концентрации ионов водорода, которые образуются в результате диссоциации воды).
4. Область после точки эквивалентности. (После т.Э. в растворе уже не будет содержаться NaOH, а будет находиться NaCl и HCl, соль NaCl на рН не влияет, на рН раствора будет влиять соляная кислота. Соляная кислота – сильный электролит, диссоциирует на ионы полностью 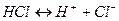 , то
, то 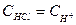 .
.
Расчет приводят в виде таблицы:
Расчет кривой титрования 10 мл 0,1 М раствора NaOH
0,1 М раствором HCl
Таблица1.1
| №п/п | Объем добавленного титранта, мл | Объем титруемого раствора, мл | Состав полученного раствора | Общий объем смеси в колбе для титрования,мл | Расчет концентрации вещества в титруемом растворе | Расчет рН раствора | рН |
| NaOH | 0,1моль/л | CNaOH= COH-=4,975·10-4моль/л СOH−= c (NaOH) = 0,1 M рОН=-lgCOH-=1 pH=14-1=13 | |||||
| NaOH + NaCl | Отношение объемов двух взаимодействующих растворов, обратно пропорционально их нормальным концентрациям: 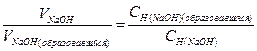 Отсюда Отсюда 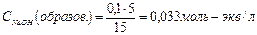 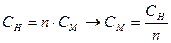 , в данном случае n=1, т.о. Сн=См , в данном случае n=1, т.о. Сн=См | 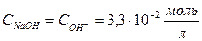 ; ; 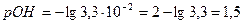 . рН=14-рОН=14-1,5=12,5 . рН=14-рОН=14-1,5=12,5 | 12,5 | ||||
| 9,90 | 0,1 | NaOH +NaCl | 19,90 | 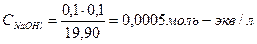 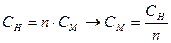 , в данном случае n=1, т.о. Сн=См , в данном случае n=1, т.о. Сн=См | Теперь мы можем найти рН полученного раствора, поскольку NaOH сильный электролит, то 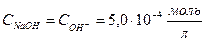 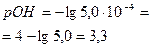 рН=14-рОН=14-3,3=10,7 рН=14-рОН=14-3,3=10,7 | 10,7 | |
| 9,99 | 0,01 | NaOH +NaCl | 19,99 | 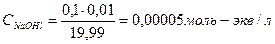 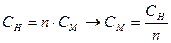 , в данном случае n=1, т.о. Сн=См , в данном случае n=1, т.о. Сн=См | 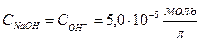 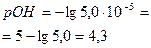 . рН=14-4,3=9,7 . рН=14-4,3=9,7 | 9,7 | |
| 10,0 | NaCl | 20,00 | СОН-=СН+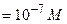 ; ; | рН=-lg 10-7=7 | |||
| 10,01 | NaCl+HCl | 20,01 | После Т.Э. рН раствора обусловлено концентрацией HCl. 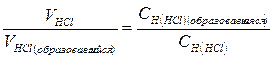 Отсюда Отсюда 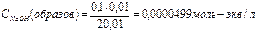 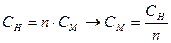 , в данном случае n=1, т.о. Сн=См , в данном случае n=1, т.о. Сн=См | Х= 0,000004997моль/л CHCl= CH+=4,997·10-5моль/л 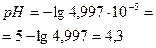 | 4.3 | ||
| 10,10 | NaCl+ HCl | 20,10 | 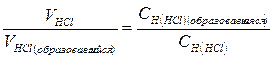 Отсюда Отсюда 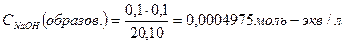 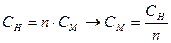 , в данном случае n=1, т.о. Сн=См , в данном случае n=1, т.о. Сн=См | Аналогично делаем вычисления, получим: CHCl= CH+=4,9975·10-5моль/л 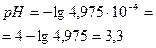 . . | 3,3 | ||
| NaCl+ HCl | 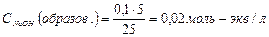 | Аналогично делаем вычисления, получим: CHCl= CH+=2.0·10-2моль/л 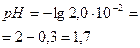 . . | 1,7 |
 2014-02-10
2014-02-10 10978
10978