ТЕРМОХИМИЯ
Термохимия – наука о тепловых эффектах химических реакций.
Основным законом термохимии является закон, установленный Рудольфом Гессом в 1841 г.
Формулировка закона Гесса: суммарный тепловой эффект одного ряда последовательно протекающих химических реакций равен сумме тепловых эффектов другого ряда последовательно протекающих химических реакций, если исходные и конечные вещества двух рядов одинаковы, а все процессы осуществляются необратимо при постоянном давлении и температуре или при постоянном объеме и температуре (изобарно-изотермические или изохорно-изотермические условия), при отсутствии полезной работы.
Закон сформулирован на основании опытных данных по тепловым эффектам химических реакций. Однако он представляет собой прямое следствие из I закона термодинамики: при изохорно-изотермическом или изобарно-изотерми-ческом процессе тепловой эффект не зависит от пути протекания химической реакции, а определяется только исходным и конечным состоянием системы. Доказательство сформулированного положения дано в предыдущем разделе (см. уравнения (11) и (12)).
1. В уравнения химических реакций, протекающих при выполнении условий закона Гесса (то есть осуществляющихся при постоянной температуре, давлении или объеме), могут быть включены тепловые эффекты этих реакций. В результате получают термохимические уравнения реакций:
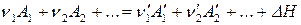
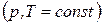
Термохимические уравнения обладают всеми свойствами обычных алгебраических уравнений: их можно почленно складывать, вычитать и т.д.
2. Тепловой эффект химической реакции равен сумме теплот образования продуктов за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов.
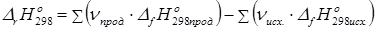 (34)
(34)
Теплотой образования вещества называют тепловой эффект синтеза 1 моль данного соединения из простых веществ.
Пример: теплота образования этана 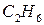 , это тепловой эффект реакции:
, это тепловой эффект реакции:
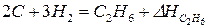 .
.
Теплоты образования простых веществ принимаются равными нулю. В справочной литературе приведены теплоты образования важнейших химических соединений в стандартных условиях. За стандартные условия приняты:
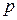 = 1 физ. атм. и любая постоянная температура (обычно
= 1 физ. атм. и любая постоянная температура (обычно 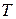 = 298
= 298 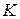 ). Если величина теплового эффекта стандартная, то она обозначается
). Если величина теплового эффекта стандартная, то она обозначается 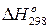 .
.
Пример. Покажем справедливость 2 следствия на следующем примере:
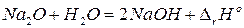 . (35)
. (35)
Запишем для этого уравнения теплоты образования всех веществ, принимающих участие в этой реакции. Когда записывают термохимические уравнения, то имеют дело с молями, а не с молекулами, поэтому возможно применение дробных коэффициентов.
1) 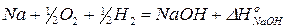 | ×2 получаем правую часть уравнения реакции
| ×2 получаем правую часть уравнения реакции
2) 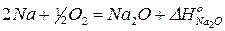
3) 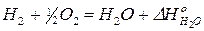
Из 1) вычтем 2) и 3) почленно и после преобразования получим:
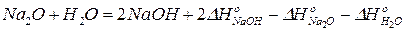 .
.
Сравнивая полученный результат с уравнением (35), имеем:
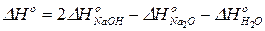 .
.
3. Тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов.
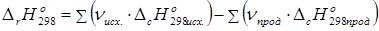 . (36)
. (36)
Теплотой сгорания вещества называют тепловой эффект химической реакции полного окисления 1 моль данного вещества молекулярным кислородом. Теплота сгорания диоксида углерода и воды принимаются равными нулю.
Пример. Покажем, что сформулированное положение вытекает как следствие из закона Гесса, на примере реакции:
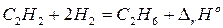 .
.
Запишем уравнения дополнительных реакций (уравнения для реакции сгорания исходных веществ и продуктов реакции):
1) 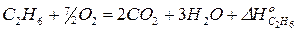
2) 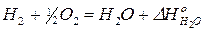 | × 2
| × 2
3) 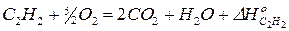
Сложим почленно 2) и 3) уравнения и вычтем из полученного результата 1) уравнение. После элементарных алгебраических преобразований будем иметь:
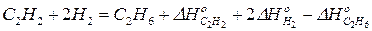
Из сравнения полученного уравнения с исходным уравнением, получим:
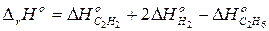 ,
,
что и требовалось доказать.
В справочной литературе можно найти величины теплот сгорания важнейших веществ в стандартных условиях.
Закон Гесса справедлив не только для химических реакций, но и для других процессов, протекающих при постоянной температуре и давлении или объеме.
 2014-02-12
2014-02-12 2851
2851








