Уравнение изотермы химической реакции.
Направление самопроизвольного протекания химической реакции определяется убылью соответствующего термодинамического потенциала, а глубина протекания абсолютной величиной этой убыли, т.е. максимальной полезной работой.
Преобразуем уравнение (107)
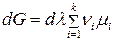 (107)
(107)
к виду: 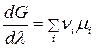 .
.
Заменим дифференциалы частными приращениями:
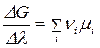 .
.
Получим уравнение для стандартного изменения 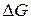 , когда
, когда 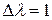 . Выразив химический потенциал компонента через его парциальное давление
. Выразив химический потенциал компонента через его парциальное давление 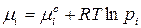 , для реакции (106) запишем:
, для реакции (106) запишем:
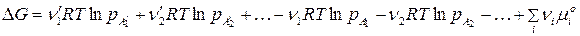 .
.
После преобразований получим:
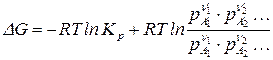 , (115)
, (115)
где 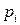 – исходные (или неравновесные) парциальные давления реагирующих веществ.
– исходные (или неравновесные) парциальные давления реагирующих веществ.
Так как при 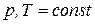 :
:  , то
, то
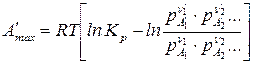 . (116)
. (116)
Аналогично для реакции, протекающей при 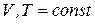 ,
, 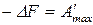 , получим:
, получим:
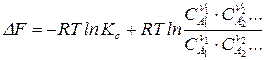 ; (117)
; (117)
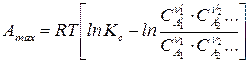 , (118)
, (118)
где 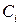 – исходные (или неравновесные) концентрации реагирующих веществ.
– исходные (или неравновесные) концентрации реагирующих веществ.
Уравнения (115, 117) – называют уравнениями изотермы химической реакции (изотермы Вант–Гоффа), а (116, 118) – уравнениями максимальной работы химической реакции.
Абсолютные значения изменения термодинамических потенциалов показывают, насколько далека система от состояния химического равновесия. Чем меньше 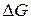 , тем ближе система к состоянию равновесия. В предельном случае когда
, тем ближе система к состоянию равновесия. В предельном случае когда 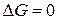 – в системе химическое равновесие. Поэтому величины
– в системе химическое равновесие. Поэтому величины 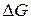 ,
, 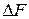 или максимальную работу процесса называют мерой химического сродства.
или максимальную работу процесса называют мерой химического сродства.
На основе уравнения изотермы химической реакции можно рассчитать максимальную работу и предсказать направление самопроизвольного протекания химической реакции. Напомним, что если
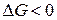 ,
, 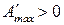 , то
, то  процесс протекает самопроизвольно в сторону образования продуктов реакции;
процесс протекает самопроизвольно в сторону образования продуктов реакции;
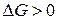 ,
, 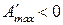 , то
, то  процесс протекает в сторону образования исходных веществ;
процесс протекает в сторону образования исходных веществ;
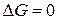 ,
, 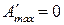 , то
, то 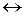 система находится в состоянии равновесия.
система находится в состоянии равновесия.
Для сравнительной оценки химического сродства различных химических реакция определяют стандартную энергию Гиббса 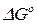 (энергию Гельмгольца
(энергию Гельмгольца 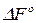 ) или стандартное химическое сродство – химическое сродство реакции, протекающей в стандартных условиях (при парциальных давлениях реагирующих веществ
) или стандартное химическое сродство – химическое сродство реакции, протекающей в стандартных условиях (при парциальных давлениях реагирующих веществ 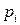 = 1):
= 1):
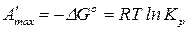 . (119)
. (119)
Аналогично для реакции, протекающей при 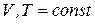 :
:
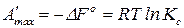 . (120)
. (120)
Для идеальных растворов в уравнении изотермы химической реакции константу равновесия выражают с помощью мольных долей (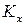 ). Для реальной газовой смеси – с помощью фугитивностей (
). Для реальной газовой смеси – с помощью фугитивностей (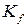 ) (уравнение 121), а для реальных растворов – с помощью термодинамических активностей (
) (уравнение 121), а для реальных растворов – с помощью термодинамических активностей (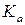 ) (122).
) (122).
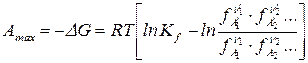 , (121)
, (121)
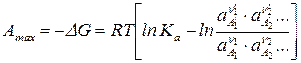 . (122).
. (122).
 2014-02-12
2014-02-12 987
987








